|
|
|
 | Introducción.
 |
La luz juega un papel
fundamental en el crecimiento y desarrollo de las plantas. Además
de la fotosíntesis, hay tres importantes procesos que afectan al
crecimiento y desarrollo vegetal que dependen de la luz.
 |
Primero, los mecanismos
de fototropismo y movimientos násticos que
responden fundamentalmente a la luz azul. |
 |
Segundo, el
fotoperiodismo,
es decir, la respuesta a las variaciones estacionales de la
longitud del día. El fotoperiodismo es consecuencia de la
absorción de luz por un pigmento ubicuo en las plantas, el
fitocromo, que absorbe fundamentalmente luz roja y roja
lejana. |
 |
Finalmente, la
fotomorfogénesis,
es decir, el crecimiento y desarrollo de las plantas
directamente controlado por la luz, que por un lado responde a
la absorción de luz azul de alta intensidad y por otro también
a la actividad del fitocromo. En este capítulo nos
centraremos en el estudio del fotoperiodismo y la fotomorfogénesis. |
|
|
 |
Fotoperiodismo.
 |
El efecto de la duración de
la longitud del día sobre la floración fue descubierto hace unos
70 años por dos investigadores del Departamento Norteamericano de
Agricultura (U.S.D.A.), W. W. Garner y H.A. Allard.
 |
Encontraron que tanto la
variedad de tabaco (Nicotiana tabacum) Maryland Mammoth
como la variedad de soja (Glycine max) Biloxi no florecían
a menos que la longitud del día fuera más corta que un valor
crítico de horas de luz. |
 |
Garner y Allard
denominaron a este fenómeno fotoperiodismo. Las
plantas que florecen solamente bajo ciertas condiciones de
luminosidad dependientes de la longitud del día se denominan
fotoperiódicas. |
 |
El fotoperiodismo es la
respuesta biológica a un cambio en las proporciones de luz y
oscuridad que tiene lugar en un ciclo diario de 24 horas
(circadianos). Aunque el concepto de fotoperiodicidad surgió
de estudios realizados en plantas, actualmente se ha
demostrado en varios campos de la Biología. |
|
|
 |
La
longitud del día es el principal factor de control de la floración.
Plantas de Día Corto (PDC) y Plantas de Día Largo (PDL).
 |
Garner y Allard consiguieron probar
y confirmar su descubrimiento con otras muchas especies de
plantas. Encontraron que las plantas son de tres tipos denominados
plantas de día corto (PDC), plantas de día
largo (PDL) y plantas de día neutro (PDN). |
 |
Las
PDC
florecen a principios de primavera o en otoño ya que deben tener
un período de luz inferior a un cierto valor crítico.
 |
Por ejemplo,
en el cadillo (Xanthium strumarium) la floración es
inducida por 16 horas o menos de luz (Figura 15.1).
Otros ejemplos de PDC son los crisantemos, las dalias, las
poinsetias, algunas compuestas, las judías, las fresas y las
primaveras.
|
 |
Figura
15.1.
La longitud relativa del día y la noche determina el
momento de floración de las plantas. Las cuatro curvas
representan los cambios anuales en la longitud del día
en ciudades de Norteamérica que están a diferentes
latitudes (Miami, 26º N; San Francisco, 37º N;
Chicago, 40º N; y Winnipeg, 50º N).
Las líneas horizontales nos muestran el fotoperíodo
efectivo de tres plantas de día corto diferentes (el
cadillo, 16 horas; la soja “Biloxi”, 14 horas; el
tabaxo, “Maryland Mammoth”, 12 horas). El cadillo,
por ejemplo, necesita 16 horas o menos de luz. EN Miami
puede florecer tan pronto como madura, pero en Winnipeg
las yemas no aparecen hasta principios de agosto, tan
tarde que, probablemente las heladas matan a la planta
antes de que las semillas sean dispersadas. (Figura modificada de Raven,
P.H., Evert, R.F. and Eichhorn, S.E.,
1999. “Biology of Plants”. 6th
ed., W.H. Freeman and Company).
|
|
|
 |
Las
PDL,
que florecen principalmente en verano, sólo lo hacen si los períodos
de iluminación son mayores que un valor crítico. La
espinaca, algunas variedades de patata, algunas variedades de
trigo, los gladiolos, los lirios, la lechuga y el beleño (Hyoscyamus
niger) son ejemplos de PDL. |
 |
Las
PDN
florecen sea cual sea la longitud del día. Ejemplos de PDN son el
pepino, el girasol, el tabaco, el arroz, el maíz y el guisante. |
 |
Hay
que tener claro que las designaciones día corto y día largo son
puramente fisiológicas. Una PDC es una planta que responde a una
longitud del día menor que un valor crítico, mientras que una
PDL es una planta que responde a una longitud del día superior a
un valor crítico. El tiempo absoluto de iluminación no es lo
importante. Por ejemplo, el cadillo (una PDC) y la espinaca (una
PDL) florecerán si se exponen a 14 horas diarias de luz. La PDC
florecerá puesto que el fotoperíodo es menor de 16 horas, su
valor crítico, mientras que la PDL también lo hará puesto que
el fotoperíodo, 14 horas, corresponde a su valor crítico.
|
 |
Actualmente,
algunos investigadores han propuesto un cuarto grupo de plantas,
las plantas de día intermedio (PDI). Estas plantas,
como la caña de azúcar, sólo florecen si se exponen a períodos
de luz de longitud intermedia. Si el período es mayor o menor que
ese rango intermedio, la planta no florece. |
 |
La respuesta
fotoperiódica puede ser extraordinariamente precisa. A 22.5 ºC,
la PDL Hyoscyamus niger
(beleño) florecerá cuando se exponga a fotoperíodos de 10 horas
y 20 minutos (ver Figura 15.2). Sin embargo, a esta
temperatura no florecerá si el fotoperíodo es de 10 horas. Las
condiciones ambientales también afectan al comportamiento
fotoperiódico. Por ejemplo, a 28.5 ºC el beleño requiere 11
horas y media de luz, mientras que a 15.5 ºC sólo requiere 8
horas y media.
|
 |
Figura
15.2.
Las plantas de día corto (PDC) florecen cuando el fotoperíodo
está por debajo de un valor crítico. El cadillo (Xanthium
strumarium) necesita 16 horas de luz para florecer. El
beleño (Hyoscyamus níger) necesita unas 10 horas
(según la temperatura) o más para florecer. Las barras de
la parte superior indican la duración de los períodos de
luz y de oscuridad en un día de 24 horas. (Modificada de Curtis,
H., and Barnes, N.,
1997. “Invitación a la Biología”. 5ª ed.
Ed. Panamericana.)
|
|
 |
La respuesta varía
con las diferentes especies. Algunas plantas sólo requieren una
única exposición al ciclo crítico luz-oscuridad, mientras que
otras, como la espinaca, necesitan
varias semanas de exposición.
 |
En muchas plantas existe una
correlación entre el número de ciclos de inducción y la rapidez
de la floración o el número de flores que se forman. |
 |
Algunas
plantas deben alcanzar un cierto grado de madurez antes de
florecer, mientras que otras son capaces de responder al fotoperíodo
adecuado cuando son plántulas. |
 |
Algunas plantas, al envejecer,
finalmente acabarán floreciendo aún cuando no estén expuestas
al fotoperíodo adecuado. Sin embargo, florecerán mucho antes con
la exposición adecuada. |
|
|
 |
Las
plantas controlan el fotoperíodo midiendo las horas de oscuridad.
 |
En 1938, otra
pareja de investigadores, Karl C. Hammer y James Bonner,
comenzaron un estudio sobre la fotoperiodicidad empleando el
cadillo como sujeto de experimentación.
 |
Como ya hemos
comentado antes, esta planta es de día corto y necesita 16
horas o menos de luz por cada ciclo de 24 horas para
florecer. |
 |
Es
particularmente útil para la experimentación porque, en
condiciones de laboratorio, una sola exposición a un ciclo de
día corto induce la floración, que tendrá lugar 2 semanas más
tarde, incluso si la planta vuelve seguidamente a condiciones
de día largo. |
 |
El cadillo
puede soportar duros tratamientos, por ejemplo, puede
sobrevivir incluso si se le quitan las hojas. |
 |
Hammer y
Bonner demostraron que la parte del cadillo que recibe el
fotoperíodo es el limbo de la hoja.
 |
No se
puede inducir la floración a una planta completamente
desfoliada. Pero si se le deja tan solo una octava parte
de una hoja extendida, una sola exposición a día corto
induce la floración. |
|
 |
En el curso de
estos estudios, en los cuales se ensayaron un gran número de
condiciones experimentales, Hammer y Bonner hicieron un
experimento crucial y totalmente inesperado. Si el período de
oscuridad se interrumpía tan sólo un minuto con luz de una
bombilla de 25 vatios, la floración no se producía.
 |
La
interrupción del período de iluminación con oscuridad
no tenía ningún efecto sobre la floración (Figura 15.3).
|
 |
Figura
15.3.
Como vimos en la figura 15.2, las plantas de día
corto (PDC) florecen cuando el fotoperíodo está
por debajo de un valor crítico mientras que las de
día largo (PDL) lo hacen cuando el fotoperíodo es
superior a un valor crítico. En esta figura vemos
como el cadillo (Xanthium strumarium)
necesita 16 horas de luz para florecer mientras que
el beleño (Hyoscyamus níger) necesita unas
10 horas (según la temperatura) o más para
florecer. Sin embargo, si el período oscuro se
interrumpe con un solo destello de luz, el beleño
también florecerá en un período de día corto. Un
“pulso” de luz durante el período de oscuridad
tiene un efecto opuesto en las plantas de día
corto: evita la floración. Las barras de la parte
superior indican la duración de los períodos de
luz y de oscuridad en un día de 24 horas. (Tomada
de Curtis, H.,
and Barnes, N.,
1997. “Invitación a la Biología”. 5ª
ed. Ed. Panamericana.)
|
|
 |
Experimentos
posteriores con otras plantas de día corto demostraron
que estas también requerían período de oscuridad
ininterrumpida más que de iluminación ininterrumpida. |
 |
La parte
del período de oscuridad más sensible a la interrupción
luminosa fue la central. Si una PDC como el cadillo, se
expone a un período de luz de 8 horas y luego a un amplio
período de oscuridad, puede demostrarse que la planta
pasa a un estado de creciente sensibilidad a las
interrupciones de luz que dura aproximadamente 8 horas,
seguido por un período en el que las interrupciones de
luz van disminuyendo su efecto. De hecho, un minuto de luz
después de 16 horas de oscuridad estimula la floración. |
|
|
 |
Basándose en los
hallazgos de Garner y Allard, los cultivadores de crisantemos habían
encontrado que podían retrasar la floración de las plantas de día
corto alargando la duración del día con luz artificial.
Fundamentándose en los nuevos experimentos de Hammer y Bonner,
fueron capaces de retrasar la floración simplemente encendiendo
la luz durante un corto período en medio de la noche. |
 |
¿Qué pasa con
las PDL? También ellas miden la oscuridad. Una PDL que florece si
se mantiene en un laboratorio durante 16 horas de luz y 8 de
oscuridad también florecerá con 8 horas de luz y 16 de oscuridad
si se interrumpe la oscuridad aunque sea con una breve exposición
de luz (Figura 15.4).
|
 |
Figura
15.4.
Diagrama que ilustra como la interrupción luminosa durante
el período de oscuridad (fotoperíodos cortos) previene la
floración en una planta de día corto y la promueve en una
de día largo. (Modificado de Ting, I.P., 1982, “Plant
Phisiology”. Addison-Wesley Publishing Company). |
|
|
 |
Base
química de la fotoperiodicidad.
 |
La siguiente clave importante en la comprensión de la
respuesta de las plantas a las proporciones relativas de luz y
oscuridad la aportó el trabajo de los investigadores de la Estación
de Beltsville, en Maryland, perteneciente al U.S.D.A. La clave se
encontró en el informe de un estudio previo realizado con semillas de
lechuga (Lactuca sativa).
 |
Las semillas de lechuga germinan
solamente si se han expuesto a la luz. Muchas semillas pequeñas
tienen este requerimiento, ya que necesitan germinar en un suelo seco y cerca de la superficie
para que las plántulas aseguren su emergencia. |
 |
Los primeros
investigadores, al estudiar los requerimientos de luz para que las
semillas de lechuga germinaran, demostraron que la luz roja estimulaba
la germinación, y que la luz de una longitud de onda ligeramente
superior (rojo lejano) la inhibía aún de forma más efectiva que la
ausencia total de iluminación. |
|
 |
Hammer y Bonner habían demostrado que cuando el período de oscuridad se
interrumpía con un solo destello de luz de una bombilla ordinaria, el
cadillo no florecía. El grupo de Beltsville, siguiendo esta línea de
investigación, empezó a experimentar con luz de diferentes
longitudes de onda, variando la intensidad y la duración de los
destellos.
 |
Encontraron que la luz roja de unos 660 nm (rojo-naranja)
era la más efectiva para prevenir la floración del cadillo y de
otras plantas de día corto. |
 |
Encontraron que también era la más
efectiva para promover la floración en plantas de día largo. |
|
 |
El
grupo de Beltsville observó que, cuando después de un destello de
luz roja se aplicaba un destello de luz roja lejana, las semillas no
germinaban.
 |
La luz roja más efectiva para inducir la germinación de
las semillas fue una luz de la misma longitud de onda que la que
estaba implicada en la floración, aproximadamente a 660 nm. Además,
encontraron que la luz más efectiva para inhibir el efecto producido
por la luz roja era la luz de una longitud de onda de 730 nm.
|
 |
La
secuencia de destellos de rojo y de rojo lejano podía repetirse una y
otra vez; el número de destellos no importaba, pero sí la naturaleza
del destello final. Si la secuencia acababa con un destello de rojo
lejano la mayoría de las semillas no germinaban (Figura 15.5).
|


 |
Figura
15.5.
La luz y la germinación de las semillas de lechuga. Figura superior: Control de la germinación en semillas de lechuga por la luz roja
(R) y por la luz roja lejana (RL).
Si la última exposición de las semillas es a la luz
roja, la mayoría de ellas germina. Sin
embargo, si la última exposición es de luz roja
lejana entonces se mantiene el estado de latencia.
En la
tabla de la figura intermedia se indican, en forma de porcentaje, el número de
semillas germinadas en base a la secuencia de iluminación recibida.
Las germinación de las semillas depende de la longitud de onda final
de la serie de exposiciones –la luz roja promueve la germinación, y
la luz roja lejana la inhibe). En
la figura inferior: Control de la germinación de semillas de lechuga por la luz roja
y por la luz roja lejana. Las semillas germinan cuando
la luz es roja, pero no cuando la luz es roja lejana. (Figuras modificadas de Moore, R., Clark,
W.D., and Vodopich, D.S.,
1998, “Botany”; 2nd ed., WCB McGraw-Hill).
|
|
|
|
 |
El descubrimiento del
fitocromo.
 |
Las
plantas contienen un pigmento que se encuentra en dos formas
diferentes e interconvertibles; Pr (la forma que absorbe
luz roja, “red”) y Pfr (la forma que absorbe luz roja
lejana, “far red”).
 |
Cuando una molécula de Pr absorbe
un fotón de luz de una longitud de onda de 660 nm se convierte en Pfr
en cuestión de segundos; cuando una molécula de Pfr
absorbe un fotón de luz roja lejana de una longitud de onda de 730 nm
se convierte rápidamente en la forma Pr en unos 20 a 30
milisegundos . |
 |
Estas reacciones reciben el nombre de reacciones
de fotoconversión. La forma Pfr es biológicamente
activa (esto es, desencadenará una respuesta, por ejemplo de
germinación), mientras que la forma Pr es inactiva (Figura
15.6). De esta forma, la molécula de pigmento puede
actuar como un interruptor biológico, conectando o desconectando las
respuestas según la forma en que se encuentre.
|
 |
Figura
15.6.
Las dos formas del fitocromo son interconvertibles. Cuando la forma Pr
absorbe luz roja (660 nm) se convierte en la forma Pfr,
mientras que la cuando la forma Pfr absorbe luz roja lejana
(730 nm) se convierte en la forma Pr.
|
|
|
 |
En estos términos
se pueden comprender fácilmente los experimentos de germinación de
semillas de lechuga. Puesto que el Pr absorbe luz roja más
eficientemente (Figura 15.7) esta longitud de onda conducirá a
la conversión de una mayor proporción de moléculas de la forma Pfr
y, por lo tanto, se inducirá la germinación. Cuando la forma Pfr
absorba luz roja lejana prácticamente todas las moléculas volverán
a la forma Pr, anulando así el efecto de la primero emisión
de luz roja. |
 |
¿A qué se debe que las plantas
florezcan conforme a los ciclos naturales de día y noche? Puesto que
la luz blanca contiene tanto longitudes de onda de rojo como de rojo
lejano, las dos formas de pigmento están expuestas simultáneamente a
los fotones que conducen a la fotoconversión a la forma opuesta. Por
lo tanto, después de recibir unos pocos minutos de luz se establece
un fotoequilibrio en el que la reacción directa (Pr  Pfr) y la reacción inversa
(Pfr Pfr) y la reacción inversa
(Pfr  Pr) se equilibran. En estas condiciones siempre hay una
proporción constante de cada forma en la población de fitocromo
(aproximadamente un 60 % de Pfr al mediodía), y esta
proporción se mantiene mientras haya luz.
Pr) se equilibran. En estas condiciones siempre hay una
proporción constante de cada forma en la población de fitocromo
(aproximadamente un 60 % de Pfr al mediodía), y esta
proporción se mantiene mientras haya luz.
|
 |
Cuando al final
del período luminoso las plantas se encuentran en la oscuridad, el
nivel de Pfr declina regularmente durante un período de
algunas horas. Si se regenera el nivel de Pfr mediante un
pulso de irradiación con luz roja a mitad del período oscuro se
inhibirá la floración en las PDC (esto es, de “noche larga”) que
sin esta interrupción habrían florecido; y, de la misma forma, se
estimulará la floración de las PDL (esto es, de “noche corta”)
que sin la interrupción no habrían florecido. En ambos casos el
efecto del pulso de luz rojo que regenera los altos niveles de Pfr
puede anularse mediante un pulso inmediatamente posterior de luz roja
lejana, que reconvierte el Pfr (Figura 15.8).
|
 |
Figura
15.8.
Esta figura nos muestra el efecto que tiene la interrupción del período
de oscuridad en plantas de día corto (cadillo) y de día largo (trébol).
Como se ve en la primera barra, en condiciones de día corto (10 horas
de luz y 14 de oscuridad) florece la PDC y no lo hace la
PDL. En condiciones
de día largo (14 de luz y 10 de oscuridad), segunda barra, florece la
PDL pero no la PDC. En la tercera barra vemos como la interrupción
del período luminoso con un corto período de oscuridad, en
condiciones totales de día largo, no afectan para nada a la floración
de las PDC (siguen sin florecer) y de las PDL (siguen floreciendo). En
la cuarta barra observamos como una breve interrupción con luz blanca
del período de oscuridad, cuando las condiciones son de día largo,
tampoco influye en los resultados, y éstos son los esperados. En la
quinta barra la interrupción del período de oscuridad con un pulso
de luz roja, sigue sin alterar los resultados esperados. Sin embargo,
en la barra sexta, vemos como la interrupción del período de
oscuridad con pulsos alternos de luz roja y roja lejana, si afecta
a la floración siempre y cuando el último pulso sea de luz
roja lejana, ya que esta convierte toda la forma Pfr que aún
permanece en la forma Pr con lo que se impide la floración
en la PDL.
|
|
 |
En
1959, Harry A. Borthwick y sus colaboradores de Beltsville llamaron a
este pigmento fitocromo y demostraron su experiencia con evidencias
irrefutables.
 |
El fitocromo está ampliamente distribuido en el reino
vegetal, encontrándose virtualmente en todas las algas y plantas
superiores. En plántulas ahiladas parece concentrarse en los
meristemos, tanto apical como cambial.
|
 |
En general las concentraciones
con demasiado bajas como para ser detectada por métodos espectrofotométricos
en hojas intactas, pero ha podido identificarse en extractos de hojas
verdes.
|
 |
En la Figura
15.9 se resumen esquemáticamente las
características principales de este pigmento, tal como se conoce
actualmente.
 |
La molécula se sintetiza de forma continua y se acumula
en la forma Pr en las plantas que están creciendo en la
oscuridad.
|
 |
La luz provoca la fotoconversión del Pr a Pfr,
el cual induce una respuesta biológica. El Pfr puede
convertirse a Pr por fotoconversión con luz roja
lejana o por reversión a Pr en la oscuridad, mediante un
proceso denominado “reversión oscura” que se da durante un
período que va de pocos minutos a algunas horas.
|
 |
El Pfr
también puede perderse por desnaturalización irreversible,
mediante un proceso denominado “destrucción” que dura algunas
horas y en el que probablemente está implicada una proteasa que lo
hidroliza. Las tres vías de eliminación del Pfr proveen
del potencial necesario para revertir las respuestas inducidas. Es
necesario puntualizar, sin embargo, que la reversión oscura sólo se
ha demostrado en dicotiledóneas, y no en monocotiledóneas.
|
 |
Figura
15.9.
El fitocromo se sintetiza inicialmente en la forma Pr a
partir de aminoácidos (designados como Pp, precursores).
El Pr se transforma en Pfr cuando se expone a
luz roja. El Pfr es la forma activa que induce la respuesta
biológica. El Pfr se reconvierte a Pr cuando se
expone a luz roja lejana. En la oscuridad, el Pfr revierte
a Pr (reversión oscura) o se destruye por una proteasa (Pd,
designa el producto de la destrucción). (Figura modificada de Raven,
P.H., Evert, R.F. and Eichhorn, S.E., 1999. “Biology of
Plants”. 6th ed., W.H. Freeman and Company).
|
|
|
|
 |
El aislamiento del
fitocromo.
En
los vegetales el fitocromo se encuentra en cantidades relativamente
pequeñas comparadas con las de los pigmentos como la clorofila. Para
detectarlo se necesita un espectrofotómetro sensible a cambios
extremadamente pequeños en la absorbancia de luz. Este tipo de espectrofotómetro no se introdujo hasta
unos siete años después de que se propusiera la existencia del
fitocromo y, de hecho, el primer uso del nuevo instrumento fue la
detección y el aislamiento de este pigmento.
 |
Se comprobó que el fitocromo era de color azul y que este
color cambiaba ligeramente en respuesta al rojo y al rojo lejano, lo
que demostraba su interconversión. La Figura 15.7 muestra los
espectros de absorción de las dos formas en que puede encontrarse
este pigmento.
 |
Este espectro de absorción es comparable al espectro
de acción de la luz roja/roja lejana sobre la floración y sobre la
germinación. Se descubrió
que la molécula de fitocromo estaba compuesta de dos partes
diferenciadas: una porción que absorbe la luz (el cromóforo) y una
gran porción proteica (Figura 15.10). |
 |
El cromóforo es muy
similar a las ficobilinas que actúan como pigmentos accesorios en las
cianobacterias y en las algas rojas. El fitocromo tiene un PM de
120,000 daltons, es soluble en agua y posee un alto contenido en aminoácidos
polares. |
 |
En la actualidad se han aislado en distintas plantas los
genes que expresan la porción proteica del fitocromo, y la secuencia
de aminoácidos se ha deducido de la secuencia nucleotídica. |
 |
La mayoría
de las plantas tienen probablemente diferentes fitocromos codificados
por una familia de genes divergentes. En Arabidopsis, se
conocen 5 genes. |
|
 |
Aún
no se ha establecido el mecanismo de trabajo específico del
fitocromo. Sin embargo, está claro que la regulación que el
fitocromo ejerce sobre la morfogénesis está mediada por cambios en
la transcripción genética. |
|
 |
Fenómenos de
inducción-reversión.
 |
En la Figura 15.11 se muestran la algunos de los procesos de
inducción-reversión mediados por el fitocromo. Algunos de los más
notables son:
 |
la promoción de la floración en PDC, |
 |
la inhibición de la
floración en PDL, |
 |
la promoción de la germinación en ciertas semillas, |
 |
y la promoción de la expansión foliar. |
 |
En PDC, Pfr inhibe la
floración mientras que en PDL la promueve.
|
 |
Figura
15.11.
Espectros de acción de algunos procesos fisiológicos que están
mediados por el fitocromo. Puede verse como los máximos de acción de
estos procesos coinciden con los picos máximos de absorción de las
dos formas del fitocromo (ver figura 5.7). (Figura modificada de Salisbury,
F.B. and Ross, C.W., 1991. “Plant
Physiology”, 2nd ed., Wadsworth Publishing Company).
|
|
|
 |
Hay dos principales hipótesis
sobre como el fitocromo regula tales procesos fisiológicos.
 |
Una hipótesis
es que el fitocromo funciona alterando las propiedades de
permeabilidad de las membranas celulares.
|
 |
La segunda hipótesis es la
de que el fitocromo opera sobre el genoma de la planta.
|
|
 |
La mayoría de
las respuestas del fitocromo ocurren con poco retraso tras el fenómeno
inductivo, lo que sugiere fenómenos de membrana. Las interacciones
fitocromo-membrana resultarían en alteraciones de los flujos
transmembranales, cambios en la compartimentalización de metabolitos,
y diferencias en la distribución de las enzimas.
|
 |
Otras de las
respuestas mediadas por el fitocromo son más lentas. La inducción de
la fenil-alanina amonio liasa (PAL) se produce unos 60 min después de
la estimulación en Brassica.
Otros fenómenos más complejos tales como la floración ocurren
siempre con algunos días de retraso, lo que estaría de acuerdo con
la segunda hipótesis.
|
 |
Algunos
estudios parecen indicar que el fitocromo se encuentra localizado
entre el citoplasma y la pared celular, como un componente de la
membrana plasmática. Se ha sugerido que durante la fototransformación
de Pr a Pfr el Pfr cambia su
orientación dentro de la membrana, lo que apoyaría la hipótesis de
que el fitocromo actúa alterando la permeabilidad de la membrana
celular. |
|
 |
El fitocromo está implicado en una amplia variedad de
respuestas de las plantas.
Actualmente
se sabe que el fitocromo está relacionado con otras respuestas
vegetales.
 |
La germinación de muchas semillas, por ejemplo, se da en
la oscuridad.
|
 |
En las plántulas, el tallo se alarga rápidamente y
empuja al brote (o, en la mayoría de las monocotiledóneas, al
cotiledón) a través del suelo oscuro. Durante esta fase del
crecimiento no hay, esencialmente, agrandamiento de las hojas; este
agrandamiento interferiría en el paso del brote a través del suelo.
Cualquier plántula que crezca en la oscuridad será alargada y
fusiforme, y tendrá hojas pequeñas. Será también casi incolora,
pues los plastos no se vuelven verdes hasta que están expuestos a la
luz. Cuando estas plántulas tienen esta forma se dice que están ahiladas
(o etioladas).
|
 |
Cuando
el ápice de la plántula sale a la luz, se pasa del crecimiento
ahilado al crecimiento vegetal normal.
 |
En las dicotiledóneas, la plántula
curvada (o gancho) se endereza, la velocidad de crecimiento del tallo
aminora ligeramente y empieza el crecimiento foliar. |
 |
En las gramíneas
cesa el crecimiento del mesocótilo (la parte axial del embrión está
entre el escutelo y el coleoptilo), el tallo se alarga y las hojas se
abren. Tales respuestas inducidas por la luz se denominan respuestas
fotomorfogenéticas.
|
|
 |
Una
plántula de judía que ha crecido en la oscuridad y que reciba, por
ejemplo, cinco minutos de luz roja al día, mostrará estos efectos de
la luz a partir del cuarto día. Si la exposición a la luz roja va
seguida de una exposición de cinco minutos a la luz roja lejana, no
aparecerá ninguno de los cambios causados habitualmente por la luz
roja. Del mismo modo, en las plántulas de los cereales, el fin del
crecimiento del mesocótilo está determinado por la exposición a la
luz roja, y el efecto de la luz roja se anula con la luz roja lejana.
|
|
 |
Un
estudio realizado en Inglaterra recientemente sugiere que en las
plantas silvestres el fitocromo ejerce una función importante al
detectar la sombra de otras plantas.
 |
La vegetación absorbe o refleja
casi completamente la radiación que está por debajo de los 700 nm
mientras que la radiación que está entre los 700 y los 800 nm (que
comprende el rojo lejano) se transmite mayoritariamente.
|
 |
En las
plantas sombreadas esto provoca un claro cambio al elevar la proporción
de Pr respecto a Pfr (esto es hay más Pfr
que se convierte en Pr) y como consecuencia provoca un rápido
incremento de la tasa de elongación internodal.
|
 |
Las
reacciones reversibles de rojo/rojo lejano también están
relacionadas con la formación de antocianos en manzanas, nabos y
coles; con la germinación de semillas; con los cambios en los
cloroplastos y en otros plastos; y con una gran variedad de otras
respuestas vegetales durante todas las etapas del ciclo vital de las
plantas. |
 |
Resumen
de procesos regulados por el fitocromo:
 |
Alargamiento
de pecíolos y entrenudos. |
 |
Formación
de primordios foliares. |
 |
Síntesis
de clorofilas y antocianos. |
 |
Crecimiento
de hojas. |
 |
Diferenciación
de estomas. |
 |
Distribución
de fotoasimilados. |
 |
Formación
de tubérculos. |
 |
Germinación
de las semillas. |
 |
Floración. |
|
|
 |
Fitocromo y
fotoperiodicidad.
 |
Cuando
se demostró por primera vez la existencia del fitocromo, sus
descubridores formularon la hipótesis de que el comportamiento del
fitocromo podría explicar la fotoperiodicidad, esto es, que la
conversión rojo/rojo lejano podría estar implicada en el mecanismo
que mide el tiempo, el reloj biológico.
 |
Según esta hipótesis el
Pfr
inhibe la floración en PDC, pero la estimula en PDL.
|
 |
En las PDC, el Pfr
podría acumularse en la luz y eliminarse en el subsiguiente período
oscuro mediante la destrucción o la reversión oscura. Cuando las
noches fueran lo suficientemente largas, se eliminaría todo el Pfr
(o una cantidad crítica), y, por lo tanto, no se inhibiría por más
tiempo la floración.
|
 |
Por otra parte, las PDL requerirían noches
cortas, durante las cuales el Pfr no sería completamente
destruido; si la noche fuera suficientemente corta quedaría la
cantidad de Pfr necesaria para inducir la floración.
|
|
 |
Sin
embargo, los experimentos han demostrado que en la mayoría de las
plantas el Pfr desaparece durante las primeras tres o
cuatro horas de oscuridad. A causa de estos experimentos y otras
observaciones, actualmente se acepta que el fenómeno de medición del
tiempo o fotoperiodicidad no está solamente controlado por la
interconversión Pfr/Pr. Deberá buscarse una
explicación más compleja. |
|
|
 |
Control Hormonal de la
Floración.
 |
Hammer
y Bonner, en sus primeros experimentos con el cadillo, demostraron que
la hoja “percibía” la luz, lo cual provocaba el desarrollo de la
yema floral. Aparentemente, de la hoja a la yema se transmite alguna
sustancia que tiene profundos efectos sobre el crecimiento y
desarrollo. Esta sustancia hipotética ha recibido el nombre de hormona
de la floración o estímulo floral.
|
 |
La hipotética hormona de la floración permanece sin
identificarse.
 |
En
la década de los años 30 algunos laboratorios empezaron a realizar,
de forma independiente, los primeros experimentos sobre el estímulo
floral. El fisiólogo vegetal M. Kh. Chailakhyan llevó a cabo algunos
experimentos justamente unos pocos años antes de que se efectuaran
los primeros estudios sobre el cadillo.
 |
Utilizando una planta de día
corto, Chrysanthemum indicum, Chailakhyan demostró que si se
deshojaba la parte superior de la planta y las hojas de la parte
inferior se exponían a un período de inducción de día corto, la
planta florecía. En cambio, si la parte superior deshojada se mantenía
en condiciones de día corto y la parte inferior con hojas se mantenía
en condiciones de día largo, la floración no ocurría (Figura 15.12). Él interpretó estos resultados como indicadores
de que las hojas producían una hormona que se dirigía al ápice
e iniciaba la floración. Chailakhyan denominó a esta hormona hipotética
florígeno, “el hacedor de flores”.
|
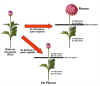 |
Figura
15.12.
Experimentos de Chailakhyan con especies de crisantemo (Chrysanthemum
sp.), una PDC. La floración ocurría cuando las hojas estaban
sometidas a fotoperíodos de día corto aunque las yemas florales
estuviesen en condiciones de día largo. Sin embargo, cuando las hojas
estaban en condiciones de día largo, la floración no se producía
aunque las yemas estuviesen en fotoperíodos de día corto. (Figura modificada de Moore, R., Clark,
W.D., and Vodopich, D.S.,
1998, “Botany”; 2nd ed., WCB McGraw-Hill).
|
|
|
 |
Experimentos
posteriores demostraron que la respuesta floral no tiene lugar si
inmediatamente después de la fotoinducción se quitan las hojas. Pero
si se dejan las hojas en la planta durante unas pocas horas después
de completarse el ciclo de inducción, pueden quitarse sin que la
floración se vea afectada.
 |
La hormona de la floración puede pasar,
por injerto, de una planta fotoinducida a una planta no fotoinducida.
Sin embargo, a diferencia de la auxina, que puede pasar a través del
agar o de tejidos muertos, el florígeno sólo puede ir de un tejido
vegetal a otro si entre ambos hay conexiones anatómicas de tejido
vivo.
|
 |
Si se descorteza una rama, esto es, si se le quita una tira
circular de corteza, el movimiento del florígeno cesa. En base a
estos datos se concluyó que el florígeno se mueve a través del
sistema floemático, vía por la que se transportan la mayoría de las
sustancias orgánicas.
|
|
|
 |
Las giberelinas pueden inducir la floración en algunas
plantas.
 |
Posteriormente
Antón Lang, entonces en el California Institute of Technology,
demostró que en algunas plantas bienales y algunas plantas de día
largo, como el apio y la col, se podía inducir la floración mediante
un tratamiento con giberelina, aún cuando las plantas estuviesen
creciendo bajo un fotoperíodo inadecuado.
|
 |
Este hallazgo llevó a
Chailakhyan a modificar su hipótesis del florígeno y a especular
sobre la posibilidad de que el florígeno realmente no fuera una
hormona sino dos, la giberelina y una antesina aún no
identificada.
 |
Según esta hipótesis, durante los fotoperíodos no
inductores las plantas de día largo producen antesina, pero no
giberelina. Por lo tanto, si en ese momento se trata con giberelina se
provoca la floración.
|
 |
Por otro lado, cuando están en condiciones no
inductoras, las plantas de día corto producen giberelina, pero no
antesina. Aunque la idea del florígeno como una combinación de
giberelina y antesina ha estimulado trabajos de investigación
considerables, desafortunadamente estos no pueden explicar una
observación crítica: a saber, que los injertos de PDC que crecen en
condiciones no inductivas no pueden provocar la floración de PDL que
también están bajo fotoperíodos no inductivos.
|
|
|
 |
Tanto sustancias promotoras como inhibidoras pueden estar
implicadas en el control de la floración.
 |
En
algunas plantas, por ejemplo en la variedad de soja (Glycine max)
Biloxi, se deben quitar las hojas de las plantas receptoras de
injertos, porque de lo contrario no florecen. Esta observación
sugiere que en las plantas no inducidas las hojas pueden producir un
inhibidor. De hecho, basándose en ello, algunos investigadores han
concluido que no hay una sustancia promotora de la floración, sino más
bien una sustancia que la inhibe a menos que sea eliminada.
Actualmente hay pruebas que sugieren que, por lo menos en algunas
plantas, tanto los inhibidores como los promotores intervienen en el
control de la floración.
|
 |
La
prueba más convincente de la existencia de ambos tipos de sustancias
inductoras e inhibidoras de la floración en la misma planta la
aportaron los estudios experimentales de Antón Lang, de la Michigan
State University, y de M. Kh. Chailakhyan
y I. A. Frolova del Timiryazev Institute of Plant Physiology de Moscú.
 |
Estos investigadores escogieron
tres clases de plantas de tabaco para sus estudios: la variedad
cultivada Trabezond de Nicotiana tabacum (una PDN), la variedad
Maryland Mamooth (una PDC), y Nicotiana silvestris (una PDL).
|
 |
Encontraron que la formación de flores en el tabaco de día neutro se
aceleraba mediante injertos de PDL cuando los injertos estaban en
condiciones de día largo, así como mediante injertos de PDC cuando
los injertos estaban en condiciones de día corto. Cuando a una PDN se
le injertaba una PDL y se exponía a días cortos, se inhibía en gran
parte la floración de la planta receptora de día neutro (Figura 15.13). En cambio, cuando a una PDN se le injertaba una PDC y se
exponía a días largos, la floración no se retrasaba o se retrasaba
sólo un poco.
|
|
 |
Figura
15.13.
Representación esquemática de los experimentos de Lang y Chailakhyan
con tres variedades de tabaco, la variedad cultivada Trabezond de Nicotiana
tabacum (una PDN), la variedad Maryland Mamooth (una PDC), y Nicotiana
silvestris (una PDL). Encontraron que la formación de flores en
el tabaco de día neutro se aceleraba mediante injertos de PDL cuando
los injertos estaban en condiciones de día largo, así como mediante
injertos de PDC cuando los injertos estaban en condiciones de día
corto. Cuando a una PDN se le injertaba una PDL y se exponía a días
cortos, se inhibía en gran parte la floración de la planta receptora
de día neutro. En cambio, cuando a una PDN se le injertaba una PDC y
se exponía a días largos, la floración no se retrasaba o se
retrasaba sólo un poco.
|
 |
Estos
resultados indican que las hojas de PDL son capaces de producir
sustancias inductoras de la floración en condiciones de día largo y
sustancias inhibidoras de la misma en condiciones de día corto, y que
ambas sustancias pueden pasar a través de un injerto, un indicio de
que son transportadas por toda la planta. En el caso del tabaco de día
corto, cuando las hojas están expuestas a condiciones de día largo,
aparentemente producen poca sustancia inhibidora de la floración o no
la producen. En caso de que sean producidas por plantas de día corto,
estas sustancias son mucho menos efectivas para retrasar la floración
que las que producen las PDL.
|
|
 |
Las
evidencias de la existencia de sustancias tanto inductoras como
inhibidoras de la floración son convincentes, pero, sin embargo, los
intentos de aislarlas han sido, hasta el momento, infructuosos. |
|
|
 |
La Fotomorfogénesis.
 |
La fotomorfogénesis se define como el crecimiento y desarrollo
directamente dependientes de la luz pero no relacionados con la fotosíntesis.
Los fenómenos fotomorfogenéticos son respuestas de alta intensidad (HIR),
y muestran dependencia de la irradiancia. Mientras que los fenómenos
de inducción-reversión sólo responden a las variaciones de la
longitud de onda de la luz, los de tipo HIR responden tanto a las
variaciones de la longitud de onda como a la irradiancia total.
 |
Algunos fenómenos HIR han sido estudiados en detalle. Por
ejemplo, la elongación internodal, la expansión de los cotiledones
en mostaza, y la biosíntesis de antocianos. Pero quizás, el ejemplo
más sobresaliente de las repuestas HIR dependiente del fitocromo sea
el ahilamiento. En la Figura 15.14 vemos dos plantas con el
mismo genotipo que fueron tratadas exactamente igual excepto en el
hecho de que una de ellas, la que presenta ahilamiento, creció en
oscuridad. El excesivo crecimiento de la planta ahilada se debe a un
incremento en la expansión celular. En ambas plantas hay similar número
de células y el mismo número de entrenudos. La HIR inhibe la
elongación de los entrenudos.
|
 |
Figura
15.14.
El efecto de la luz en el desarrollo de las plantas. Las dos plantas
surgieron a partir del mismo lote de semillas y crecieron bajo las
mismas condiciones excepto en que la planta de la derecha recibía
una iluminación normal (períodos de día/noche) mientras que la de
la izquierda se mantenía en total oscuridad. (Figura tomada de Ting, I.P., 1982, “Plant Phisiology”.
Addison-Wesley Publishing Company).
|
|
|
 |
En
la Figura 15.15 se muestra un espectro de acción para las HIR.
Se muestran dos tipos de experimentos.
 |
En uno, las plantas cultivadas
en la oscuridad se expusieron a cortos intervalos de luz de distintas
longitudes de onda. La luz roja de 660 nm se muestra como la más
efectiva para inhibir la elongación internodal. Esta respuesta del fitocromo se muestra similar a la que ocurre
en los fenómenos de inducción-reversión en los que la forma Pr
es fototransformada en la forma activa Pfr. |
 |
Sin embargo, si
las plantas ahiladas se someten a una exposición a la luz por períodos
de 6 a 12 horas, el espectro de acción es bastante diferente.
Aparecen máximos de respuesta a 550 nm (luz azul) y a 730 nm (luz
roja lejana). |
 |
La respuesta en los experimentos de larga exposición es
la misma que la que se produce en los de corta exposición, es decir,
la interrupción de la elongación internodal. |
 |
Mohr y sus
colaboradores propusieron en 1966 que la luz azul en las HIR produce Pfr
que dispara la respuesta fotomorfogenética de la elongación
internodal. La causa de porqué hay un pico en el rojo lejano no está
enteramente clara puesto que la luz roja lejana conduciría a la
transformación del Pfr a Pr, previniendo la
respuesta. Las plantas actuarían como si estuvieran en la oscuridad
con un ahilamiento máximo. |
 |
Mohr concluyó que una larga exposición a la luz roja lejana
mantendría suficiente fitocromo en la forma Pfr como para
causar la fotomorfogénesis. El espectro de acción mostrado en la Figura
15.15 es típico de las respuestas de alta energía de la
fotomorfogénesis.
|
 |
Figura
15.15.
Espectro de acción para la respuesta morfogenética de alta
intensidad. En períodos breves de iluminación (inducción) aparece
un pico a 660 nm. En irradiaciones prolongadas (de 6 a 12 horas) el
espectro de acción muestra picos en la zona del azul y del rojo
lejano. (Figura
modificada de Ting, I.P., 1982, “Plant Phisiology”.
Addison-Wesley Publishing Company).
|
|
|
 |
Una respuesta fotomorfogenética frecuentemente estudiada es la
inhibición de la elongación de los hipocótilos en las plántulas de
mostaza. La inhibición muestra una típica respuesta HIR. Como se
muestra en la Figura 15.16, los hipocótilos se elongarán
linealmente durante al menos 18 horas si crecen en oscuridad. Si se
someten a luz roja lejana de forma continua, se inhibe la elongación.
El proceso de inhibición de la elongación en el hipocótilo de plántulas
de lechuga muestra un espectro de acción que presenta un pico de eficiencia en la luz azul y roja lejana, típica de
las HIR. |
 |
La elongación de los hipocótilos y de los entrenudos en las
plántulas son buenos ejemplos de fotomorfogénesis controladas por el
fitocromo. Las respuestas fotomorfogenéticas tienen lugar con muy
poco o ningún retraso. Las respuestas fotomorfogenéticas positivas,
tales como la expansión de los cotiledones y la biosíntesis de
antocianos, tienen períodos de algunas horas (Figura 15.16).
|
 |
Figura
15.16.
Experimento de Mohr que muestra como cortos pulsos de luz roja lejana
inhiben la elongación del hipocótilo. La inhibición se produce con
muy poco tiempo de retraso. (Figura modificada de Ting, I.P., 1982, “Plant Phisiology”.
Addison-Wesley Publishing Company).
|
|
 |
En 1966 Mohr estudió la biosíntesis relacionada con el
fitocromo de los antocianos en un intento de descifrar el mecanismo de
acción del fitocromo. El crecimiento de las plántulas de mostaza en
la oscuridad no producen niveles significantes de antocianos. Si embargo, la biosíntesis de antocianos comienza con un retraso
de algunas horas (Figura 15.17). La biosíntesis muestra el fenómeno
típico de inducción-reversión cuando se asocia con cortos períodos
de luz roja y roja lejana. Además, la cantidad de antocianos
producida es dependiente de la intensidad luminosa típica de las HIR.
Por ello, la biosíntesis de antocianos es una típica respuesta HIR.
|
 |
Figura
15.17.
Inducción por la luz roja lejana de la biosíntesis de antocianos en
mostaza. La respuesta se produce con un marcado período de retraso.
No se forman antocianos en la oscuridad. (Figura modificada de Ting, I.P., 1982, “Plant Phisiology”.
Addison-Wesley Publishing Company).
|
|
|
 |
Vernalización.
 |
Es
un hecho comprobado que no todas las plantas florecen cuando se las
somete al fotoperíodo adecuado. En muchas especies vegetales, la
temperatura influye de manera decisiva sobre la iniciación y
desarrollo de los órganos reproductores.
|
 |
La
necesidad que presentan ciertas plantas de pasar por un período de frío
para poder florecer, quedó demostrada cuando se comprobó que en la
mayoría de las plantas bienales un tratamiento frío artificial
seguido por condiciones de fotoperíodo y temperaturas adecuadas
permitía la floración de la planta durante la primera temporada de
su crecimiento. De esta manera, se puede hacer florecer una planta
bienal en el mismo período de tiempo requerido para la floración de
plantas anuales.
|
 |
La vernalización, término empleado para describir este fenómeno, ha
sido definido como la adquisición de la capacidad de florecer, o su
aceleración, mediante la utilización de un tratamiento frío. En
sentido estricto, la vernalización es la promoción específica de la
iniciación de la floración por un tratamiento frío previo durante
la fase de semilla hidratada o de planta joven. La vernalización es sólo
un proceso inductivo que determina una aptitud para la floración,
pero, normalmente, ésta
sólo se manifiesta bajo las condiciones de fotoperíodo y
temperaturas adecuadas.
|
 |
Son
muchas las plantas que precisan vernalización para poder florecer.
Entre ellas, se incluyen los cereales de invierno (se siembran en otoño,
vegetan durante el invierno y espigan al año siguiente), la mayoría
de las plantas bienales y un elevado número de plantas perennes.
 |
El
período frío invernal es esencial para los cereales de invierno, Si
no lo sufren no espigan, o su floración es escasa y, por tanto, la
producción final se reduce considerablemente.
|
 |
Muchas plantas bienales
permanecen en estado vegetativo durante años cuando se las protege
del frío invernal. Las especies perennes que precisan vernalización
deben pasar por un período frío cada invierno para poder florecer
todos los años.
|
|
 |
La
duración del período de vernalización es muy variable ya que
depende básicamente de la especie, e incluso, de la variedad. Se
suele medir en “días de frío” a los cuales tiene que estar
sometida una planta para que pueda florecer.
|
 |
Por
otra parte, la necesidad de vernalización puede ser absoluta, como en
muchas plantas bienales que no pueden florecer sin ella, o relativa,
como en muchas de las
plantas anuales de hábito invernal, trigo (Triticum aestivum)
y centeno (Secale cereale) entre otras, que responden
cuantitativamente a la vernalización (Figura 15.18). En estas últimas plantas, la respuesta de floración es tanto
más positiva cuanto mayor es el tiempo de vernalización. Así, la
vernalización completa requiere unos 50 días de frío con
temperaturas comprendidas entre –2 y 12º C (los óptimos de
temperatura se sitúan entre 2 y 5 ºC).
|
 |
Figura
15.18
La duración de la exposición a bajas temperaturas afecta a la
estabilidad del efecto vernalizante. En el caso del centeno (Secale
cereale), cuanto más
tiempo están expuestas las plantas al efecto vernalizante, mayor número
de plantas permanece vernalizada aún cuando al estímulo vernalizante
le siga un tratamiento desvernalizante. En la experiencia de la gráfica,
semillas de centeno que habían sido embebidas en agua se expusieron a
temperaturas de 5º C durante diferentes longitudes de tiempo
(semanas), y a continuación, se expusieron a un efecto
desvernalizante de 3 días a 35º C. (Figura modificada de Taiz, L.
and Zeiger, E., 1998, “Plant Phisiology”. 2nd ed., Sinauer Associates, Inc.,
Publishers).
|
|
 |
En general, la respuesta de
floración ante la vernalización depende de la temperatura usada y de
la duración del período de vernalización. La combinación de
temperaturas y tiempos de exposición que resulta más eficaz para
conseguir una respuesta máxima debe determinarse para cada especie
vegetal.
|
 |
Se
suele considerar al ápice del tallo como la parte de la planta que
responde inicialmente al tratamiento frío. Al parecer, el ápice
caulinar es el punto de percepción de la vernalización, y el estímulo
es transportado a las otras partes de la planta (Figura 15.19).
|
 |
Figura
15.19 La transmisión del factor inductor de la floración inducida
por frío se transmite a través de los injertos. En (a) se muestra
como una planta de beleño sin tratamiento vernalizante es incapaz de
florecer. Si se le implanta un injerto de otra planta similar sin
estimular por frío, tampoco florece la receptora (b). Sin embargo, si
en la planta receptora (c) se implanta un injerto de una planta de
beleño vernalizada (en oscuro) se produce la floración en ambas
plantas, lo que indica que el efecto vernalizante se transmite a través
de los injertos. (Figura modificada de Ridge, I. (ed.), 1991. “Plant Physiology”. Hodder & Stougnton Ltd in association with The Open
University (S203), Biology: Form and Function, Book 3).
|
|
 |
Sin embargo, se ha comprobado
que los tejidos vegetales jóvenes aisladas de hojas, tallos y raíces
pueden ser vernalizados. Si se les somete a un tratamiento frío, las
plantas regeneradas a partir de ellos florecen normalmente. Por esto
se ha llegado a la conclusión de que para la percepción de la
vernalización es necesaria la presencia de células en división, sin
importar cuál sea su localización en la planta.
 |
En principio,
cualquier tejido de la planta en fase de división celular es un punto
de percepción potencial de la vernalización. Una vez que el tejido
ha recibido el estímulo vernalizador la inducción es ya permanente.
Es decir, la células originadas a partir de células vernalizadas
mantienen siempre la vernalización. También los embriones de las
semillas pueden ser vernalizados.
|
|
 |
El
efecto inductor de la vernalización puede ser revertido por un
tratamiento inmediato posterior a altas temperaturas (próximas a 30º
C). Este efecto se conoce como desvernalización y es tanto más
intenso cuanto más corto haya sido el tratamiento frío.
|
|
 |
Control hormonal de la
vernalización.
 |
Desde
hace varios años, se ha especulado mucho sobre la existencia de una
sustancia con actividad específica en la vernalización, la hipotética
“vernalina”. Dicho compuesto provocaría la floración en plantas
vernalizadas. Hoy en día, aún no se ha demostrado la existencia
fisiológica de la “vernalina”. Hasta el momento no se ha
encontrado un esquema molecular de los posibles cambios desencadenados
por la vernalización es un verdadero proceso metabólico más que un
simple mecanismo físico por el frío.
|
 |
Algunos
reguladores de crecimiento influyen sobre las necesidades de
vernalización de las distintas especies vegetales. Así, el ácido
giberélico (GA3) induce tanto la formación de tallos como
la floración en plantas que precisan vernalización, como la
remolacha (Beta vulgaris).
|
 |
En
general, en algunas especies de desarrollo invernal o en algunas
plantas bienales, ciertas giberelinas inducen el entallamiento, la
floración o ambos procesos, sin necesidad de que la planta tenga que
pasar por un período de frío (Figura 15.20).
|
 |
Figura
15.20 Inducción de la floración en plantas de zanahoria (Daucus
carota) por tratamiento con frío o por la adición de giberelinas:
(a) planta sin tratamiento frío y sin adición de giberelinas
(control); (b) planta sin tratamiento frío pero con adición de
giberelinas; (c) planta con tratamiento frío y sin adición de
giberelinas. (Figura tomada de Lang, 1957. Proceedings of the National Academy of Sciences, 43: 709-713)
|
|
 |
Ejemplos
de plantas que requieren vernalización: |
|
 |
Vernalización y
fotoperíodo.
 |
Uno
de los numerosos puntos oscuros de la vernalización es su interacción
con los requerimientos de fotoperíodo).
|
 |
Aunque
en muchas plantas, y en especial las de día largo, parece estar
asociada la necesidad de vernalización con la de fotoperíodo (Figura
15.21) no se conocen aún con exactitud qué relación existe entre
la inducción de la floración por vernalización y su inducción por
fotoperíodo.
|
|
 |
Vecería
 |
Fenómenos
que se presenta en aquellas plantas (generalmente árboles
frutales: naranjo, peral, ciruelo, etc.), que producen mucho fruto
un año y poco o ninguno en otro. |
 |
Es
debido:
 |
a
que producen escasas yemas florales los años de fuerte
cosecha, o |
 |
a
que producen abundantes yemas pero posteriormente muchas se
pierden durante la época estival los años de buena cosecha. |
|
 |
Causas:
 |
falta
crítica de sustancias nutritivas (al haber muchos frutos los
nutrientes se almacenan en ellos teniendo las yemas menor
disponibilidad de los mismos) o |
 |
a
la acción de inhibidores que se originan en los frutos. |
|
|
|

