|
|
|
 | Regulación
del crecimiento y desarrollo: las hormonas vegetales o
fitorreguladores.
 |
Una planta, para crecer, necesita luz, CO2,
agua y elementos minerales, incluido el nitrógeno, del suelo. Con
todos estos elementos, la planta fabrica materia orgánica,
convirtiendo materiales sencillos en los complejos compuestos orgánicos
de que están compuestos los seres vivos. La planta no se limita a
aumentar su masa y su volumen, sino que se diferencia, se
desarrolla, adquiere una forma y crea una variedad de células,
tejidos y órganos. ¿Cómo puede una sola célula, el zigoto, ser
el origen de las variadísimas partes ─ vástago, raíz,
flor, fruto, semilla ─ que componen el extraordinario
individuo conocido como una "planta normal"? Muchos de
los detalles de cómo están regulados estos procesos no son
conocidos, pero ha quedado claro que el desarrollo normal depende
de la conjunción de numerosos factores internos y externos. Los
principales factores internos son compuestos químicos, y éstos
vas a ser el objeto de la presente unidad temática. Algunos
factores externos ─ luz, temperatura, longitud del día,
gravedad, y otros ─ que también afectan al desarrollo de
las plantas serán discutidos en la unidad siguiente. |
 |
Las sustancias controladoras del crecimiento en las
plantas son conocidas como fitohormonas (hormonas
vegetales).
 |
Características:
 |
Son pequeñas moléculas químicas que afectan
al desarrollo y crecimiento de los vegetales a
muy
bajas concentraciones.
 |
Por ejemplo, en el vástago de una piña tropical (Ananas
comosus) sólo se encuentran 6 mgramos de ácido indolacético
(auxina), una conocida fitohormona, por kilogramo de material
vegetal (el peso de la hormona en relación con el vástago es
comparable al peso de una aguja en 22 toneladas de heno). |
|
 |
Son sintetizados por las plantas. |
 |
En las hormonas animales, su definición
incluye el hecho de que son sintetizados en un lugar del
organismo y transportados a otro distinto donde ejercen su
acción. En las hormonas vegetales esto no es
necesariamente cierto. |
|
|
 |
El término "hormona" procede de
una palabra griega (hormaein) que significa excitar. No
obstante, hoy se sabe que muchas hormonas tienen efectos
inhibitorios. De modo que en lugar de considerar las hormonas como
estimuladores, quizá sea más útil considerarlas como reguladores
químicos.
 |
La
respuesta a un "regulador" particular depende no sólo
de su contenido (estructura química) sino de cómo es
"leído" por el receptor (especificidad tisular). |
 |
Definición
de fitohormona:
Compuesto orgánico sintetizado en una
parte de la planta y que se transloca a otra parte donde, a
muy bajas concentraciones, elicita una respuesta fisiológica.
 |
No todas las fitohormonas son necesariamente
translocadas (el etileno, p.e.). |
 |
Algunos compuestos inorgánicos (Ca2+, K+) producen respuestas
fisiológicas y pueden moverse por la planta pero por no
ser sintetizados por ella no se consideran
hormonas vegetales. |
 |
Lo mismo podemos decir de algunos
fitorreguladores sintéticos como el 2,4-D (análogo auxínico). |
 |
La sacarosa no es una hormona aunque la fabrica
la planta, se transloca y produce efectos en el desarrollo
debido a que se necesita en grandes cantidades. Lo mismo respecto a otros metabolitos (>1
mM - 50 mM o más ) |
|
|
 |
Se conocen cinco grupos principales de hormonas vegetales o fitohormonas:
las auxinas, las citocininas, las giberelinas,
el etileno y el ácido abscísico.
 |
Todas
ellas actúan coordinadamente para regular el crecimiento en
las diferentes partes de una planta (Figura 14.1). |
 |
Otras sustancias
que eventualmente pueden clasificarse como fitohormonas son: las poliaminas,
los jasmonatos, el ácido salicílico,
los brasinosteroides, y la sistemina.
 |
Figura 14.1
Coordinación hormonal del crecimiento en diferentes
partes de una planta. (AIA es el ácido
indolacético, una auxina; CQ, citocinina; ABA,
ácido abscísico; AG, ácido giberélico).
[Figura modificada de
Rost,
T.I et
al., (1997). "Plant Biology".Wadsworth
Publishing Company] |
|
|
 |
¿Cómo
actúan las fitohormonas? Dos mecanismos generalmente aceptados:
 |
La
hormona atraviesa la membrana celular de la célula
diana y alcanza el citoplasma.
 |
Allí
se une a una molécula adecuada (receptor) y forma un
complejo hormona-receptor. A partir de aquí, el complejo
puede disociarse o puede entrar en el núcleo como tal y
afectar a la síntesis de los ARNm. Esta efecto sobre la transducción
es lo que produce la respuesta fisiológica. |
|
 |
La
hormona se une a un receptor de membrana en la célula
diana.
 |
La
unión hormona-receptor produce en este último un cambio
conformacional que conduce a una cascada interna de
reacciones citoplásmicas que pueden producir efectos muy
variados: nuevas actividades enzimáticas, modificación
de procesos metabólicos, inducción de síntesis de ARNm,
etc. |
|
|
|
 |
Las
auxinas.
 |
Algunas
de las primeras experiencias registrados sobre sustancias
reguladoras del crecimiento fueron llevados a cabo por Charles
Darwin y su hijo Francis y fueron dados a conocer en el libro The
Power of Movement in Plants (La capacidad del movimiento en
las plantas), publicado en 1881.
 |
Los Darwin trabajaron con plántulas
de alpiste (Phalaris canariensis) y de avena (Avena
sativa) y realizaron las primeras observaciones sistemáticas
referentes a la encorvadura hacia la luz (fototropismo).
 |
Probaron que si se cubría la parte superior de una plántula (el
denominado coleoptilo; Figura 14.2) con un cilindro de metal o con un
tubo de vidrio ennegrecido con tinta china y se le exponía a una
luz lateral, no se producía el encorvamiento característico en
la parte inferior del vástago (Figura 14.3). En cambio, si
en los ápices se colocaban tubos de vidrio transparentes, el
encorvamiento ocurría normalmente.
|
|
|
 |
Otras
experiencias: Boysen-Jensen
(1913); Paal (1919) |
 |
En
1926, el fisiólogo vegetal holandés Frits W. Went consiguió
aislar esta "influencia" de las plantas que la
desencadenaba.
 |
Went cortó los ápices de los coleoptilos
correspondientes a cierto número de plántulas de avena y los
colocó por espacio de una hora sobre láminas de agar, de modo
que las superficies de corte estuviesen en contacto con el agar.
 |
Entonces cortó el agar en pequeños cubitos y los colocó,
descentrados, en cada sección de los brotes decapitados, las
cuales fueron mantenidas en oscuridad durante todo el experimento. |
 |
Al cabo de una hora, observó una curvatura apreciable hacia el
lado contrario de donde estaba colocado el bloque de agar (Figura
14.4). Los bloques de agar que no habían sido puestos en
contacto con ápices de coleoptilo no producían encorvadura
alguna, o bien producían una ligera curvatura hacia el lado en
que había sido colocado el bloque de agar. Los bloques de agar
que habían sido puestos en contacto con un trozo de coleoptilo de
la parte baja no produjeron ningún efecto fisiológico.
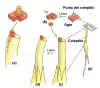
 |
Figura
14.4 Experimentos de Went. (a) Went cortó los ápices de los
coleoptilos y los colocó en agar durante 1 hora. (b) El agar era
luego cortado en pequeños bloques y cada uno de ellos se colocaba en
un lado de los coleoptilos decapitados de las plántulas. (c) Las plántulas,
que se mantenían en oscuridad durante la experiencia, se curvaban
entonces hacia el lado opuesto a donde se había colocado el bloque de agar
(d). A partir de estos resultados, Went concluyó que la
"influencia" que causaba la curvatura en la plántula era un
compuesto químico y que se acumulaba en el lado opuesto a la zona
iluminada. (e) La curvatura es el resultado de la influencia de la
hormona auxina. Su efecto es el de promover el alargamiento celular.
En el experimento de Went, las moléculas de auxina (puntitos negros)
se transfirieron primero al agar y luego, mediante los cubitos de
agar, a un lado del brote de la plántula. [Figura modificada de Curtis,
H. y Barnes, N.S. (1997). “Invitación a la Biología”.
Ed. Panamericana].
|
|
|
 |
Con
estos experimentos, Went demostró que el ápice del coleoptilo
ejerce sus efectos mediante un estímulo químico (es decir, una
hormona), más bien que con un estímulo físico, tal como uno de
naturaleza eléctrica. Este estímulo comenzó a conocerse con el
nombre de auxina, término creado por Went a partir de la
palabra griega auxein, "aumentar". |
|
|
 |
La
auxina resultó ser químicamente el ácido indolacético.
 |
La
curvatura producida en el coleoptilo de avena a causa de la
colocación de un bloque de agar conteniendo auxina se debe a una
distribución asimétrica de ésta, que se traduce en un
incremento asimétrico del tamaño celular en el coleoptilo; las células
situadas debajo del bloque de agar con auxina, tienen un mayor
crecimiento en longitud que aquéllas situadas en el extremo
opuesto. Las condiciones para la utilización de los coleoptilos
de avena y la colocación de los bloques de agar se ha
estandarizado de forma que el ángulo de curvatura producido
(medido con un protractor) puede ser usado para determinar la
cantidad de auxina presente en dicho bloque. Utilizando esta técnica,
conocida como bioensayo de la curvatura de la Avena, algunos
investigadores fueron capaces de aislar e identificar la auxina
que se encuentra de forma natural en las plantas. Esta resultó
ser químicamente el ácido indolacético (AIA, de forma
abreviada). |
 |
Como
puede verse en la Figura 14.5, el AIA se parece mucho al
aminoácido triptófano, y probablemente es éste el precursor del
AIA formado en la planta viva, aunque se conocen cuatro vías de
formación del AIA cada una de ellas con un intermediario
distinto. Diferentes grupos de plantas emplean distintas rutas
para producir AIA a partir del triptófano. Además, algunas
plantas, tales como el maíz (Zea mays) emplean distintas
rutas según su estado de desarrollo. La auxina se produce en los
ápices de los coleoptilos de las gramíneas y en los meristemos
apicales de los tallos y, en menor proporción, de las raíces.
También se encuentra en los embriones, en cantidades notables,
y en las hojas jóvenes, flores y frutos.
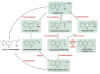 |
Figura
14.5
Biosíntesis
del ácido indolacético (indol 3-acetato; auxina) a partir de
triptófano en plantas y en bacterias. Las enzimas que sólo se
presentan en bacterias están marcadas con un asterisco. El NAD+
y el NADP+ se sintetizan también a partir del triptófano.
[Figura modificada de Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
|
 | La auxina se fabrica principalmente en los meristemas apicales de los
brotes y de allí se mueve a otras partes de la planta, siempre en
dirección de tallo a raíz (basipetal). En el tallo la auxina es
indispensable para el crecimiento. En la Figura 14.6
podemos ver la estructura del ácido indol-3-acético y de otras
auxinas naturales.


|
Figura
14.6
(Arriba) Estructura de algunas
auxinas naturales. Aunque el ácido indol-3-acético (AIA; IAA) se
encuentra en todas las plantas, otros compuestos relacionados también
poseen actividad auxínica. En guisantes, por ejemplo, aparece el ácido
4-cloroindol-3-acético (4-Cl-IAA). Otros compuestos que no son
indoles, como el ácido fenilacético (AFA, PAA) también poseen
actividad auxínica. No está claro el papel que juegan estas otras
auxinas en el desarrollo de la planta.
Las
formas disociadas del AIA y de la auxina sintética 2,4-D
muestran las cargas negativas presentes sobre el grupo
carboxilo y la cargas positivas sobre el anillo, separadas
entre si 5.5 Å. (Abajo) Ejemplos de algunas auxinas
sintéticas. La mayoría de ellas se emplean como herbicidas
en horticultura y agricultura. Las más empleadas son las
señaladas con un recuadro azul oscuro, es decir, el ácido
2-metoxi-3,6-diclorobenzoico (dicamba) y el ácido 2,4-diclorofenoxiacético
(2,4-D) ya que son muy estables y no son degradados por las
plantas. [Figuras modificadas de Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
|
|
 | Efectos
fisiológicos producidos por la auxina.
|
 | La
auxina estimula la elongación celular.
 |
La
auxina incrementa la extensibilidad de la pared celular: hipótesis
del crecimiento ácido.
 |
Los
efectos estimulantes de las auxinas sobre el crecimiento de
tallos y raíces es la consecuencia del alargamiento celular.
Bajo la influencia de la auxina, la plasticidad de la pared
celular aumenta y la célula se ensancha en respuesta a la
turgencia que provoca la entrada de agua en la vacuola (Figura
14.7). |
 |
Las
auxinas activan las proteínas transportadoras de iones
hidrógeno (H+) de la célula a la pared
celulósica. Como resultado de este movimiento, la pared
celular se acidifica y esto hace activar una enzima de la
pared celular que rompe los enlaces cruzados entre las cadenas
de celulosa. Esto permite que las moléculas se deslicen entre
sí al aumentar la turgencia sobre la pared celular (Figura
14.7). |
 |
Esta
respuesta llamada crecimiento
ácido es rápida y se produce a los 3-5 minutos,
alcanzando un máximo a los 30 minutos y finalizando al cabo
de 1 a 3 horas.
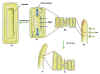 |
Figura 14.7 Las auxinas
y el alargamiento celular y la curvatura de los tallos
hacia la luz. (a) Con el estímulo luminoso, la
auxina se desplaza hacia el lado oscuro del tallo, (b)
con lo que aumenta la concentración de la hormona en
ese lado. (c) En estas células, la mayor concentración
de auxina estimula el transporte de H+ del
citoplasma a la pared celular (flechas negras curvas).
La acidez que se origina activa una enzima de la pared
celular que rompe los enlaces puente entre las
moléculas de celulosa, con lo que la plasticidad de la
pared se ve aumentada. El agua que entra por ósmosis en
la vacuola celular hace aumentar la turgencia (flechas
azules verticales) y la célula se alarga (d). Las
células situadas en el lado iluminado no se alargan (e)
y, como resultado, el brote se curva hacia la luz.
[Figura modificada de
Curtis,
H. y Barnes, N.S. (1997). “Invitación a la Biología”.
Ed.
Panamericana].
|
|
|
|
 |
La
auxina producida por la yema apical caulinar inhibe el desarrollo de
las yemas laterales.
 |
Poco
tiempo después del descubrimiento de la auxina y del
reconocimiento de su actividad en la regulación de la elongación
célula, se descubrió un efecto inhibidor de la misma en relación
a las yemas laterales.
 |
Por ejemplo, si el meristemo apical de una
planta de judía se corta, las yemas laterales comienzan a
desarrollarse. Sin embargo, si se aplica inmediatamente auxina en
la superficie de corte, se inhibe el desarrollo de las yemas
apicales (Figura 14.8).
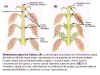 |
Figura 14.8
Dominancia apical en Coleus. (a) La auxina que
se sintetiza en el meristema apical caulinar se difunde hacia abajo,
reprimiendo el crecimiento de las yemas axilares. Cuanto mayor sea la
distancia entre el ápice y la yema axilar, menor será la concentración
de auxina, y menor será la represión sobre la yema. (b) Si el meristema apical se corta, eliminándose la producción de auxina, las
yemas axilares quedan desinhibidas y comienzan a crecer vigorosamente.
[Figura modificada de Curtis, H. y
Barnes, N.S. (1997). “Invitación
a la Biología”. Ed. Panamericana].
|
|
|
 |
Al igual que ocurre con la respuesta fototrópica de las
plántulas de Avena, esta forma de "dominancia apical"
demostraba una forma de "comunicación" entre dos
tejidos de la planta mediada por el AIA (Figura 14.9 y animación
14.1). Además,
en ambos casos la "influencia" se mueve desde la zona de
crecimiento hacia la base de la planta (flujo unidireccional).
Esto es debido a que la auxina se transporta activamente en las
plantas desde los ápices de los vástagos hasta las zonas basales;
es lo que se denomina, dirección basipetal.
 |
El movimiento ocurre
normalmente en los tejidos como un todo a través de las células,
más bien que usando los conductos del xilema y del floema.
Presumiblemente, el proceso de transporte implique una interacción
entre el AIA y la membrana plasmática de las células de la
planta.
 |
Figura
14.9 Esquema hipotético del transporte polar de las
auxinas. El modelo quimiosmótico del transporte polar de las auxinas se
muestra en una columna de células situadas en un ápice de
coleoptilo. Las bombas
ATPasa-H+ usan la energía de los ATP para mantener un
adecuado gradiente de protones y de pH entre el citoplasma y la pared
celular. Esto conduce a que la pared tenga un pH ácido (5) y por
tanto un exceso de cargas positivas. Ambos factores juegan un papel
fundamental en el modelo quimiosmótico del transporte auxínico.
Observar como los transportadores de AIA– se encuentran siempre en
la zona polar de las células. La salida de protones a la pared
celular actúa sobre las moléculas de celulosa de la misma. Los
enlaces dentro de la pared primaria, se debilitan, y se produce una
expansión celular impulsada por la turgencia. La dirección de la
expansión la marca la orientación neta de las microfibrillas de la
pared celular. Esta respuesta va seguida por efectos a largo plazo. [Figura modificada de
Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
|
|
 |
La
aplicación de auxina a las plantas causa una variedad de
efectos, que difieren según la edad de la planta, la especie, y más
particularmente, el tejido donde actúa. Al igual que ocurre con
otros compuestos químicos fisiológicamente activos, la auxina es
tóxica a altas concentraciones.
 |
El herbicida 2,4-D es una auxina
sintética, una de las varias que han sido sintetizadas
artificialmente para una amplia gama de aplicaciones. |
|
|
 |
Las
auxinas y la diferenciación celular.
 |
Según
han demostrado experimentos efectuados por W.P. Jacobs, las
auxinas influyen sobre la diferenciación del tejido vascular
durante el alargamiento del tallo. Si se corta y se separa un
trozo de tallo de Coleus de forma que se retire parte del
tejido vascular del mismo, en su lugar se formarán nuevos tejidos
vasculares originados por células de la médula. |
 |
Efectos
parecidos se observan en los callos. Un callo es una masa
de células indiferenciadas que se forma en las heridas de las
plantas o en los cultivos de tejidos a partir de células
aisladas. Si sobre un callo de tejido vascular de lila (Syringa)
se injerta una yema, se induce la formación de tejido vascular en
el callo. Igualmente, si se cultiva un callo en un medio que
contiene auxina y azúcar (puesto que el callo no comprende células
fotosintetizadoras), se forman tejidos vasculares. El
descubrimiento que se describe a continuación, realizado por R.H.
Wetmore y sus colaboradores, es bien curioso. Regulando la
cantidad de azúcar en el medio, se puede inducir la formación de
xilema sólo, de xilema y floema, o de floema sólo. Una
concentración baja de sacarosa (del 1.5 al 2.5 %) favorece el
xilema; una del 4 % favorece al floema; y una concentración
comprendida entre las indicadas
favorece la producción de ambas a la vez. Aquí se llega a
un punto que es necesario señalar que ninguna de estas sustancias
reguladoras del crecimiento actúa sola. Sus efectos son
conseguidos, generalmente, en concomitancia con otros factores
internos (tales como el azúcar disponible), unos conocidos y
otros no, que actúan en el cuerpo de la planta. |
|
 |
La
auxina y el cámbium vascular.
 |
En
las plantas leñosas, la auxina promueve el crecimiento del cámbium.
Cuando en la primavera empiezan a crecer las regiones meristemáticas
del vástago, la auxina que desciende desde los ápices
vegetativos hace que las células cambiales se dividan, formando
floema secundario y xilema secundario. También en este caso,
estos efectos son modulados por otras sustancias controladoras del
crecimiento en el cuerpo de la planta (Figura 14.10).
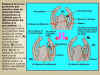 |
Figura 14.10 Esquema
de un experimento que muestra cómo un primordio foliar
proporciona un estímulo para la diferenciación del xilema
en el procámbium. La muesca que separa el procámbium aísla
el tejido de interés por encima de él. (A) control
con un primordio foliar intacto. (B) Se ha retirado
el primordio foliar. (C) Se ha retirado el primordio
foliar y se ha reemplazado con una gota de auxina. La auxina
es el sustituto efectivo del estímulo del primordio. [Figura modificada de
Rost,
T.I et
al., (1997). "Plant Biology".Wadsworth
Publishing Company]
|
|
 |
Experimentos
realizados con AIA aplicado externamente junto con ácido giberélico
indican que, en la planta intacta, las interacciones entre las
auxinas y el ácido giberélico determinan las velocidades
relativas de producción de floema secundario y xilema secundario.
 |
Por ejemplo, el AIA y el ácido giberélico estimulan la actividad
cambial cuando se aplican a una amplia variedad de plantas leñosas.
Sin embargo, el, AIA en ausencia del ácido giberélico estimula
solamente el desarrollo del xilema. Con ácido giberélico sólo,
se estimula el desarrollo de floema solamente, pero el desarrollo
de ambos simultáneamente alcanza un máximo con la presencia de
AIA y ácido giberélico. |
|
|
 |
La
auxina promueve el desarrollo de raíces laterales.
 |
La
auxina, en cantidades pequeñísimas, puede estimular el
crecimiento de las raíces. No obstante, en cantidades algo
mayores, inhibe el crecimiento de las raíces primarias, aunque
puede promover la formación de nuevas raíces secundarias.
Estimula el desarrollo de las raíces adventicias y por esta razón
se emplean comercialmente para estimular la formación de raíces
en esquejes, especialmente en el cultivo de plantas leñosas (Figuras
14.11 y 14.12).
 |
Figura 14.11
Esquejes
de flor de Pascua (Ilex
opaca). Desarrollan fácilmente raíces en el
extremo de los
tallitos cuando sus bases son tratadas con auxinas. El
extremo de los tallos se sumerge durante 5 segundos en
soluciones conteniendo 50% de etanol y 0.01% (A) y 0.5% (B)
de ácido naftalénacético, NAA (una auxina sintética).
Luego fueron cultivados en vermiculita húmeda durante 2
semanas. [Figura modificada de Rost, T.
et al. (1998).
Plant Biology. Wadsworth Publishing Company].
|
 |
Figura 14.12 El pecíolo de la hoja de
saintpaula (izquierda) se ha colocado en una solución de
auxina sintética durante 10 días antes de tomar la fotografía. El pecíolo de la hoja de la
derecha ha estado en agua pura. Se observa el crecimiento de
raíces adventicias en el pecíolo de la izquierda. Los
jardineros emplean preparados de hormonas inductoras de
enraizamiento que contienen auxinas para estimular el
desarrollo de las raíces. [Figura tomada de
Moore,
R. et al.(1998), Botany. WCB McGraw-Hill. ]
|
|
|
 |
La
auxina y el desarrollo del fruto.
 |
La
auxina promueve el crecimiento del fruto. Ordinariamente, si la
flor no ha sido polinizada, el fruto no se desarrolla.
 |
En algunas
plantas es suficiente la fecundación de un único saco
embrionario para el normal desarrollo del fruto; pero en otros
frutos tales como manzanas o melones, que tienen muchas semillas,
deben ser fecundadas varias de éstas para que la pared del ovario
madure y se haga carnosa. |
 |
Tratando el gineceo de una flor con
auxina, es posible obtener un fruto partenocárpico (del
vocablo griego parthenos, que significa "virgen"
o "doncella"), o lo que es lo mismo, un fruto originado
sin haber sido fecundadas sus semillas, como en el caso del tomate
o de la uva sin semillas. |
|
 |
Aparentemente,
las semillas en desarrollo son una fuente de auxina.
 |
En la fresa (Fragaria
ananassa), si se extirpan las semillas durante el desarrollo
del fruto, que son aquenios, éste deja por completo de crecer. Si
se deja una estrecha banda de semillas, el fruto (en el caso de la
fresa el receptáculo carnoso) desarrolla un cíngulo abombado en
el área ocupada por las semillas. Si se aplican auxinas al receptáculo
despojado de semillas, el crecimiento tiene lugar de manera normal
(Figura 14.13).
 |
Figura 14.13
La
auxina producida por el embrión que se está formando
promueve la maduración de las paredes del ovario y el
desarrollo de los frutos. (A) Fresa normal
(Fragaria ananassa). (B) Fresa en la que se han extraído todos los frutos
(aquenios). Si se hubiera aplicado una pasta conteniendo
auxinas, el crecimiento de la fresa hubiera sido normal.
(C) Fresa a la que se han extraído una tira
horizontal de aquenios. [Figura tomada de
Curtis, H. y
Barnes, N.S. (1997). “Invitación
a la Biología”. Ed. Panamericana].
|
|
|
|
 |
La
auxina y el gravitropismo.
 |
A
diferencia de lo que ocurre con el estímulo luminoso unilateral,
la gravedad no actúa en forma de gradiente entre las partes
superiores e inferiores de un órgano. Todas las partes de una
planta experimentan el estímulo
gravitacional de forma semejante. ¿Cómo detectan las células de
una planta la gravedad? La única forma en que la gravedad puede
ser detectada es a través del movimiento de un cuerpo cayendo o
en estado de reposo. Unos buenos candidatos en las células
vegetales son los grandes y densos amiloplastos presentes en
muchas de estas células. Estos amiloplastos son lo
suficientemente densos con respecto al citoplasma donde se
encuentran como para que se sedimenten en el fondo de las células
debido a la gravedad (Figura 14.14). Los amiloplastos que
las plantas emplean para detectar la gravedad se denominan estatolitos
y se encuentran en células especiales denominadas estatocitos. |
 |
En
las raíces, que
tienen gravitropismo positivo, los estatocitos se localizan entre
las células de la cofia. Siempre que la raíz esté creciendo
adecuadamente, los estatolitos estarán sedimentados en las
paredes basales de las células. Sin embargo, cualquier variación
en la dirección del crecimiento hará que los estatolitos se
desplacen hacia las paredes laterales de los estatocitos,
alterando así la correcta redistribución de auxina entre las células
radicales (Figura 14.15)
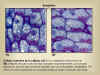 |
Figura 14.14 Células
centrales de la caliptra. (A) En su orientación
vertical normal. (B)
Después de que la raíz se haya colocado horizontalmente.
Los cuerpos globulares oscuros que contienen almidón son
los amiloplastos (estatolitos). Se observa como su posición
en la célula cambia al variar la posición de la raíz. [Figura modificada de
Curtis, H. y
Barnes, N.S. (1997). “Invitación
a la Biología”. Ed. Panamericana].
|
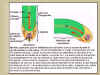 |
Figura 14.15 Modelo propuesto para la
redistribución del calcio y de la auxina durante el
gravitropismo en las raíces. El
AIA es sintetizado en el tallo y transportado a la raíz vía
sistema vascular. Cuando la raíz está vertical, los estatolitos se depositan en la parte
basal de las células de la caliptra. Los iones Ca2+ y
la auxina (que se transportan acropetalamente en la raíz)
se reparten por igual dentro de la corteza en la zona de elongación, promoviendo la
elongación. Cuando la raíz está horizontalmente, los
estatolitos se caen por su peso hacia las paredes laterales
de las células, lo que dispara el transporte de Ca2+ y
la auxina hacia un sola mitad de la cofia. La llegada a la corteza de concentraciones muy elevadas de auxina produce la
inhibición del crecimiento y provoca la curvatura de la raíz. [Figura modificada de
Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
|
|
 |
La
auxina retrasa el comienzo de la abscisión en hojas.
 |
En
las hojas jóvenes se produce auxina, pero parece que ésta no
tiene efecto directos sobre la velocidad de crecimiento de las
hojas. En cambio, influyen sobre la abscisión (caída de las
hojas o de otras partes de la planta).
 |
Las hojas caen de los árboles
a causa de la formación de una zona de abscisión, capa
peculiar de células parenquimáticas débiles y de paredes finas,
en la base del pecíolo.
 |
Cuando la hoja se hace vieja, ciertos
iones reutilizables y moléculas son retornadas al tallo, entre
ellos los iones magnesio, aminoácidos, y azúcares (algunos
derivados del almidón). Entonces, en algunas plantas al menos,
diferentes enzimas rompen las paredes celulares de las células
que forman la zona de abscisión. |
 |
Los cambios en las paredes
celulares puede incluir debilitamiento de la lamela media e hidrólisis
de las fibras de celulosa. Antes de caer la hoja se desarrolla una
capa de súber debajo de la zona de abscisión, que sirve para
taponar la cicatriz. Eventualmente, la hoja queda sujeta al árbol
solamente por unas pocas fibras de tejido vascular, que puede
romperse debido al alargamiento de las células parenquimáticas
que se encuentran en la capa de separación. |
|
 |
La abscisión ha sido
correlacionada, entre otras cosas, con una disminución de la
producción de auxina en la hoja; bajo ciertas circunstancias, la
abscisión puede ser prevenida por la aplicación de auxina. |
|
 |
El
control de la abscisión de las hojas, flores, y frutos es
extremadamente importante en la agricultura. La auxina y, más
recientemente, el etileno (ver más adelante) han sido usados
comercialmente para el tratamiento de un número de especies
vegetales.
 |
Por ejemplo, la auxina previene la caída de hojas y
bayas de los acebos (Ilex aquifolium) y por lo tanto
minimiza pérdidas durante el transporte. L |
 |
a auxina también
previene la caída previa a la recolección de frutos cítricos,
un efecto muy importante comercialmente en la producción de
naranjas. |
 |
Por otro lado, grandes cantidades de auxina, debido a
elevada producción de etileno, producen la caída de los
frutos. |
|
|
 |
La
auxina y el control de las malas hierbas.
 |
Las
auxinas sintéticas han sido empleadas extensivamente para el
control de las malas hierbas en las zonas agrícolas. En términos
económicos, este es el mayor uso práctico que se realiza de los
reguladores del crecimiento de las plantas. Aunque un número de
compuestos puede ser empleado para ello, las fenoxi auxinas tales
como el 2,4-D y sus derivados químicos son importantes
herbicidas y representan aproximadamente el 20 % de los empleados. |
|
 |
¿Cómo
actúa la auxina?
 |
La
auxina incrementa la plasticidad de la pared celular. Cuando la
pared celular se ablanda, la célula se dilata debido a la presión
del agua dentro de su vacuola (presión de turgencia). A medida
que se reduce la presión del agua, por dilatarse la célula, ésta
toma más agua y de este modo continua agrandándose hasta que la
pared opone resistencia. |
 |
Según
parece, el ablandamiento de la pared celular no es debido a la
interacción directa entre el AIA y los constituyentes químicos
de la pared. Tanto la biosíntesis del ARN como la de proteínas
son necesarias para que se dé este efecto de ablandamiento; si
son inhibidas, no se observa ni ablandamiento ni crecimiento.
Estudios realizados en células caulinares demostraron que el AIA
incrementaba la biosíntesis de celulasa, la enzima que digiere la
celulosa. Los tejidos vegetales tratados con AIA tienen de 12 a 14
veces más celulasa que los no tratados, en condiciones idénticas.
Así, es presumible que, por lo menos, algunos de los efectos
producidos en la pared celular por la auxina provengan de la
producción de nuevo RNA mensajero codificador de la celulasa, la
cual rompe las trabazones que impiden el crecimiento de la pared
celular (Figura 14.16).
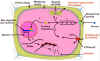 |
Figura 14.16 Posibles etapas en
la acción de la auxina. (1) El AIA se enlaza a un receptor de membrana específico
(señalado en la membrana plasmática); (2) el complejo AIA-receptor
interactúa con otros ligandos, iniciando una cadena de eventos bioquímicos;
(3) las bombas de protones de la membrana se activan, acidificando la
pared celular y causando su debilitamiento; (4) se estimulan la síntesis
y secreción de los componentes de la pared celular; (5) proteínas
reguladoras migran desde el citosol al núcleo; (6) estas proteínas
se enlazan a sus sitios reguladores en genes específicos, estimulando
la transcripción; (7) la traducción de los ARNm regulados por auxina
conducen a proteínas que intervienen en el crecimiento celular. [Figura modificada de
Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
|
 |
Sin
embargo, experimentos recientes han puesto de manifiesto que
pueden ser detectadas respuestas de crecimiento en tejido de
coleoptilo dentro de los 10 minutos posteriores a la aplicación
de la auxina. Este efecto es demasiado rápido para que haya
producción de nuevo ARN mensajero, responsable de la síntesis de
la celulasa. Esto nos hace pensar que la producción de celulasa
no es el modo de acción primario de la auxina sobre la
pared de la célula vegetal. Uno de los efectos primarios del
tratamiento con auxina implica cambios en el metabolismo celular
que producen un rápido bombeo de protones a través de la
membrana celular (Figura 14.9). La acidificación
resultante de la pared celular conduce, por un mecanismo
desconocido, a la hidrólisis de los puentes que unen las
distintas moléculas dentro de la pared y, consecuentemente, a la
elongación celular forzada por la presión de turgencia. Se han
obtenido pruebas de esta hipótesis del crecimiento ácido
recientemente y que ayudan a entender mejor el mecanismo de acción
de las auxinas. Se ha comprobado el hecho de que soluciones ácidas
(pH 5.0-5.5) causan una elongación similar a la producida por el
tratamiento con auxinas, mientras que tampones neutros, al
prevenir la acidificación, inhiben el efecto de las auxinas sobre
la elongación celular. |
 |
Aunque
se piensa que esta hipótesis es la más adecuada para explicar el
alargamiento inicial como respuesta al tratamiento con auxina, no
puede explicar el efecto continuado de los tratamientos con auxina
sobre las plantas. De hecho, muchos investigadores afirman ahora
que las auxinas tienen dos efectos diferentes sobre la elongación
celular: un efecto a corto tiempo, rápido, causado por la hipótesis
ácida y un segundo efecto, continuado, debido a la regulación de
la expresión génica. Se ha demostrado que la auxina produce la
expresión de 10 genes específicos, todos presumiblemente
implicados en el crecimiento celular. Se sabe que la etapa
afectada por las auxinas es la transcripción. Este efecto de las
auxinas sobre la expresión génica parece ser similar al de
algunas hormonas en los animales. |
|
 |
Citocininas.
 |
El
descubrimiento de la auxina estimuló a muchos investigadores a
buscar otros tipos de compuestos químicos que regulasen el
crecimiento debido a que, al igual que ocurre en los animales,
parecía improbable que el crecimiento y desarrollo de las plantas
estuviese regulado sólo por una hormona. La búsqueda se concentró,
especialmente, en hormonas que regulasen la división celular.
Estos compuestos se han encontrado en todas las plantas,
particularmente en los tejidos que se dividen de forma activa como meristemas, semillas en germinación,
frutos en maduración y raíces en desarrollo. Estas hormonas se
llamaron citocininas (de “citocinesis”) o citoquininas. Los
estudios sobre la acción de las citocininas en la división
celular han demostrado que son necesarias en algunos procesos
posteriores a la replicación del ADN pero anteriores a la
mitosis.
 |
En
1892, Wiesner propuso la existencia de factores estimulantes de la
división celular. |
 |
En
1913, Gottlieb Haberlandt descubrió que un compuesto
encontrado en el floema tenía la capacidad de estimular la
división celular en células de parénquima. |
 |
En
1941, Johannes van Overbeek y más
tarde F.C. Steward y sus colaboradores, descubrieron
que el endosperma líquido del coco también tenía esta
capacidad. |
 |
En
1954, Jablonski and Skoog ampliaron el trabajo de Haberlandt
mostrando que los tejidos vasculares contienen sustancias que
estimulan la división celular. |
|
|
 |
Miller
y Skoog descubrieron la kinetina, una citocinina artificial.
 |
En 1955, tras experiencias previas realizadas con ADN de esperma de arenque,
Folke Skoog y Carlos Miller consiguieron preparar por tratamiento
térmico de ADN un compuesto, el 6-furfurilamino purina, que
promovía la división celular. Denominaron
a esta sustancia kinetina y llamaron a los reguladores
que se incluían dentro de este grupo citocininas,
debido, como dijimos anteriormente, a su aparente implicación en
los procesos de citocinesis, o división celular.
 |
Como se observa
en la Figura 14.17, la kinetina se parece a la base púrica
adenina, que fue la clave que condujo a su descubrimiento.
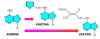 |
Figura
14.17 Notar
las similitudes entre la purina adenina y estas cuatro citocininas.
La kinetina y la 6-benzilamino-purina (BAP) son citocininas sintéticas
comúnmente usadas. La Zeatina y la i6Ade se han aislado de
plantas. [Figura modificada de Raven, P.H. & Eichhorn, S.E.
(1999). Biology of Plants. 6th ed., W.H. Freeman and Company. Worth Pub.].
|
|
 |
La
kinetina, que probablemente no existe en las plantas de modo
natural, tiene una estructura relativamente simple, y los bioquímicos
han sido capaces de sintetizar una gran variedad de otros
compuestos relacionados que se comportan como citocininas. |
|
 |
En
1964, Letham y sus colaboradores aislaron una citocinina natural a partir de semillas de maíz (Zea mays), a la que
denominaron zeatina, la cual es la citocinina natural más
activa que se conoce.
|
 |
Actualmente
se han aislado citocininas de muchas especies diferentes de
plantas, donde se encuentran, fundamentalmente, en órganos
cuyos tejidos se están dividiendo de forma activa, es decir, en
semillas, frutos, y raíces. Recientemente, las citocininas se
han identificado en dos plantas vasculares sin semilla, un
equiseto (Equisetum arvense) y el helecho Dryopteris
crassirhizoma. |
|
 | Efectos
fisiológicos producidos por las citocininas.
 |
La respuesta puede variar dependiendo del tipo de citocinina y
de la especie vegetal.
 |
Estimulan
la división celular. |
 |
Estimulan
la morfogénesis (iniciación de tallos/formación de
yemas) en cultivo de tejidos. |
 |
Estimulan el desarrollo de las yemas laterales. Contrarresta
la dominancia apical. |
 |
Estimulan la expansión foliar debido al alargamiento
celular. |
 |
Pueden incrementar la apertura estomática en algunas
especies. |
 |
Retrasan
la senescencia foliar
al
estimular la movilización de nutrientes y la síntesis de
clorofila.. |
 |
Promueven la conversión de etioplastos en cloroplastos via
estimulación de la síntesis de clorofila. |
 |
Estimulación de la pérdida de agua por transpiración. |
 |
Eliminación de la dormición que presentan las yemas y
semillas de algunas especies. |
 |
Estimulan la formación de tubérculos en patatas. |
|
|
 |
Las
citocininas regulan el ciclo celular.
 |
Los
estudios de las interacciones que envuelven a la auxina y a las citocininas
están ayudando a los fisiólogos a entender cómo
las hormonas de las plantas (fitohormonas) trabajan para producir
el patrón de crecimiento global de cada planta. Es obvio que una
célula vegetal indiferenciada tiene dos opciones: bien puede
alargarse, dividirse, alargarse, y volverse a dividir de nuevo, o
bien puede alargarse sin sufrir posteriores divisiones. Las células
que se dividen repetidamente permanecen esencialmente
indiferenciadas, o meristemáticas, mientras que las células que
se alargan tienden a diferenciarse, o especializarse.
 |
En estudios
realizados con tallos de tabaco, la adición de AIA a los cultivos
de tejidos produjo una rápida expansión celular, por lo que se
formaron células gigantes. |
 |
La adición de kinetina sola tuvo poco
o ningún efecto. |
 |
El AIA más la kinetina produjo una rápida
división celular, por lo que se produjo un gran número de células
relativamente pequeñas e indiferenciadas. |
 |
En otras palabras, la
adición de kinetina, junto con el AIA (aunque no con kinetina sólo)
condujo a las células a un estado meristemático. |
|
|
 |
La
relación auxina/citocinina regula la morfogénesis en cultivos de
tejidos.
 |
Alterando
ligeramente las concentraciones relativas de auxina y citocinina,
los investigadores han podido modificar el desarrollo de las células
indiferenciadas de los cultivos de tejidos.
 |
Una concentración más
o menos igual de las dos hormona, hace que las células sigan
indiferenciadas, formando masas de tejido llamadas callos. |
 |
Cuando
la concentración de auxina es superior, el tejido indiferenciado
organiza raíces. |
 |
Con una concentración superior de
citocinina,
se forman yemas. Con un cuidadoso equilibrio de las dos hormonas
se puede producir raíces y yemas, y por lo tanto, una plantita
incipiente. (Figura 14.18).
 |
Figura
14.18 Esquema del
control de la diferenciación ejercido por la interacción de la
auxina con las citocininas. Las piezas de los tejidos de la médula
del tabaco se cultivaron asépticamente en un medio nutritivo (cultivo
de tejidos) completando varias con varias concentraciones de dos
hormonas. Según las proporciones relativas de auxina y citocinina,
el callo de varias especies de plantas continuará creciendo como
tejido sin diferenciar, y podrá formar raíces o formar yemas y
tallos. [Figura
modificada de Rost, T. et al. (1998).
Plant Biology. Wadsworth Publishing Company].
|
|
|
 |
En
otros estudios realizados en cultivo de tejidos, usando tejido de
tubérculo de la aguaturna (Helianthus tuberosus), se
descubrió que un tercer componente, el ión calcio, puede
modificar la acción de la combinación auxina-citocinina.
 |
En
estos estudios, el AIA más bajas concentraciones de kinetina
conducían a un alargamiento celular, pero cuando se añadía Ca2+
al cultivo se inhibía el alargamiento para favorecerse el proceso
de división celular. |
 |
Altas concentraciones de calcio prevenían
la expansión de la pared celular, por lo que las células no crecían
y cambiaban su ciclo al de división celular. |
 |
Es por ello, que no
sólo las hormonas modifican los efectos de otras hormonas, sino
que estos efectos combinados son a su vez modificados por factores
no hormonales, tales como el calcio. |
|
|
 |
Las
citocininas retrasan la senescencia (envejecimiento).
 |
Otra
función, al parecer independiente, de las citocininas es la de
prevenir la senescencia o envejecimiento de las hojas. En la mayoría
de las especies de plantas, las hojas comienzan a volverse
amarillas tan pronto como se extraen de la planta. Este
amarilleamiento, el cual se debe a la pérdida de clorofila, puede
prevenirse usando citocininas (Figura 14.19).
 |
Figura 14.19
Efecto
de las citoquininas sobre la senescencia en hojas. La
aplicación de citoquininas a la hoja de la derecha,
procedente de una plántula de judía (Phaseolus vulgaris),
inhibe su senescencia normal. Comparar con el aspecto de la
hoja de la izquierda, que no fue tratada con la hormona. [Figura
tomada de Rost, T.
et al. (1998).
Plant Biology. Wadsworth Publishing Company].
|
 |
Las hojas de cadillo (Xanthium
strumarium), por ejemplo, cuando son arrancadas y dejadas en
agua del grifo, se vuelven amarillentas en el término de unos
10 días. Si se añade una pequeña cantidad de kinetina (10 mg
por litro) al agua, se conserva gran parte de la clorofila y, en
consecuencia, la apariencia fresca de la hoja. Si las hojas
arrancadas son rociadas con soluciones de kinetina, las zonas
mojadas
permanecen verdes, mientras que el resto de la hoja se amarillea.
No obstante, si la hoja rociada con citocininas contiene aminoácidos
radiactivos marcados con 14C, se puede ver que los
aminoácidos emigran hacia las zonas que han sido tratadas con citocininas.
 |
Tales estudios, que han sido llevados a cabo sobre rábanos
y otras plantas, propician la hipótesis de que el envejecimiento
en las hojas, y probablemente en otras partes de la planta,
resulta del progresivo "despido" de fragmentos de ADN, y
de la consiguiente mengua en la producción de ARNm y en la síntesis
de proteínas. |
 |
Estas investigaciones sugieren la hipótesis de que
las citocininas previenen la pérdida de fragmentos de ADN,
permitiendo así que continúe la síntesis de enzimas
y la producción de otros compuestos tales como la
clorofila. |
|
|
 |
Una
interpretación de la prevención por las citocininas de la
senescencia en hojas arrancadas es la de que las hojas normalmente
no sintetizan suficiente citocininas como para satisfacer sus
propios requerimientos. Por esto, una cuestión importante y todavía
sin resolver implica al lugar o lugares de producción de las citocininas
dentro de las plantas. Basándose en algunas líneas
de evidencia, una posible localización es la raíz. Un segundo
lugar podría ser la zona de elongación situada debajo del ápice
caulinar. |
|
 |
¿Cuál
es el modo de acción de las citocininas?
 |
Desde
el primer aislamiento de citocininas a partir de muestras de ácidos
nucleicos, los fisiólogos vegetales han sospechado siempre que
estas hormonas han de estar de algún modo relacionadas con los
ácidos nucleicos. Cuando Holley y sus colaboradores desvelaron
por primera vez la estructura de una molécula de ARNt, se
encontraron con que la molécula contenía un cierto número de
bases atípicas. Más tarde se descubrió que en algunos tipos de
ARNt la citocinina natural i6Ade (6N-isopenteniladenina),
que es a su vez una base atípica, está incorporada en la molécula.
La i6Ade se encuentra, por ejemplo, en las moléculas
de ARNt para la serina y para la tirosina, en las cuales está
ubicada inmediatamente junto al anticodón. Sin embargo, todavía
no se sabe si su presencia o su ubicación en moléculas de ARNt
está relacionada con su actividad promotora de la división
celular. Se conoce que el último efecto de las citocininas implica cambios en la expresión génica, probablemente a nivel
transcripcional. |
 | Modos
de acción:
 |
Regulan
la síntesis proteica. |
 |
Afectan
las etapas post-transcripcionales en algunas especies. |
 |
Su
presencia en los ARNt pueden regular la síntesis proteica. |
|
|
 |
El
etileno.
 |
Durante
un período de años, el descubrimiento de la auxina condujo, más
o menos directamente, al aislamiento de la kinetina y el
reconocimiento de los efectos de las citocininas sobre el
crecimiento de las plantas y su desarrollo. El etileno, por otro
lado, era un compuesto que se conocía desde antiguo y se sabían
sus efectos sobre el crecimiento mucho antes de que se le
relacionase con la auxina; era considerado ya como una fitohormona.
 |
El
etileno fue usado en la práctica desde el antiguo Egipto, en
donde se trataban con gas los higos para estimular su
maduración. En la antigua China se quemaba incienso en
locales cerrados para incrementar la maduración de las peras. |
|
 |
La
historia botánica del etileno, un hidrocarburo sencillo (H2C=CH2),
se remonta al siglo pasado, cuando las ciudades se iluminaban con
lámparas de gas. En Alemania, se demostró que el gas que se perdía
desde las lámparas de gas era el principal causante de la
desfoliación que ocurría en los árboles que se encontraban en
las calles. Como el gas comenzó a usarse de modo intensivo para
la iluminación de las calles, este fenómeno fue registrado por
muchos investigadores.
 |
En
1901, D. Neljubov demostró que el etileno era el componente
activo del gas que se empleaba en iluminación. Neljubov notó que
la exposición de plántulas de guisante a dicho gas en oscuridad
(plantas etioladas) reducía el elongamiento del tallo,
incrementaba el crecimiento lateral, y producía un anormal
crecimiento horizontal de la plántula (gravitropismo negativo),
condiciones que más tarde se denominaron la triple respuesta.
 |
Cuando los componentes gaseosos del gas fueron probados
individualmente se demostró que todos eran inactivos excepto el
etileno, que producía la triple respuesta a concentraciones tan
bajas como 0.06 partes por millón (ppm) en el aire. |
 |
Los
descubrimientos de Neljubov han sido confirmados por muchos otros
investigadores, y se sabe que el etileno ejerce una influencia
principal sobre la mayoría, sino todos, los aspectos del
crecimiento, desarrollo, y senescencia de las plantas. |
|
 |
La primera indicación
de que el etileno era un producto natural de los tejidos vegetales
fue descrita por H.H. Coussin en 1910. Coussin observó que cuando
se mezclaban naranjas con bananas en el mismo contenedor, las
bananas maduraban prematuramente. |
 |
En
1917, Doubt descubrió que el etileno estimulaba la
abscisión. |
 |
En 1934,
R. Gane identificó al etileno químicamente como
un producto natural del metabolismo de las plantas, y debido a sus
efectos sobre el desarrollo de las mismas se le clasificó como
una fitohormona. |
 |
En
1935, Crocker propuso que el etileno era la hormona
vegetal responsable de la maduración de los
frutos. |
|
 |
El etileno, aunque es un gas en condiciones
normales de presión y temperatura, se disuelve en cierto grado en
el citoplasma de las célula. Se considera como una hormona
vegetal debido a que es un producto natural del metabolismo y a
que interacciona con otras fitohormonas en cantidades traza. Los
efectos del etileno pueden ser apreciados particularmente durante
períodos críticos ─maduración de los frutos, abscisión
de frutos y hojas, y la senescencia─ del ciclo de vida de
una planta. |
|
 |
Los
ambientes estresantes y las concentraciones elevadas de auxinas
promueven la producción de etileno en los tejidos vegetales.
 |
El
etileno es normalmente la hormona más fácil de ensayar. Puesto
que es un gas que se libera por los tejidos, no requiere extracción
ni purificación antes de su análisis por cromatografía gaseosa. |
 |
La biosíntesis del etileno comienza con el aminoácido metionina,
el cual reacciona con ATP para formar un compuesto conocido como
S-adenosilmetionina, abreviadamente SAM (Figura 14.20). |
 |
A
continuación, el SAM se excinde en dos moléculas diferentes, una
de las cuales contiene un anillo compuesto de tres átomos de
carbono. Este compuesto, conocido
como ácido 1-aminociclopropano-1-carboxílico (ACC), se convierte
en etileno, CO2, y amonio por una enzima presente en el
tonoplasto, todavía no aislada, denominada enzima formadora de
etileno (EFE). |
 |
Aparentemente, la reacción formadora de
ACC es la etapa de la ruta que es afectada por algunos
tratamientos o estados fisiológicos (por ejemplo, altas
concentraciones de auxina, heridas, polución atmosférica,
maduración de los frutos, senescencia de las flores,
encharcamiento, etc.) que estimulan la producción de etileno por
los tejidos vegetales.
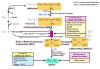 |
Figura
4.20 Biosíntesis del etileno y su regulación.
El aminoácido metionina es el precursor del etileno en los tejidos de
todas las plantas superiores. La etapa limitante de la ruta biosintética
es la conversión de la S-adenosilmetionina (SAM) en el intermediario
precursor del etileno, el ácido 1-aminociclopropano-1- carboxílico
(ACC), etapa catalizada por la ACC sintasa. Otras abreviaturas: AVG,
aminoetoxivivilglicina; AOA, ácido aminooxiacetico. [Figura modificada
de Taiz, L. & Zeiger, E. (1998).
Plant Physiology. 2nd ed. Sinauer Associates, Inc., Publishers].
|
|
|
 | Efectos
fisiológicos producidos por el etileno.
|
 |
El
etileno y la maduración de los frutos.
 |
La
maduración de los frutos engloba un número de cambios (ver tabla
14.1). En los frutos carnosos baja el contenido en clorofila,
pudiéndose formar otros pigmentos, causantes del cambio de color
del fruto. Al mismo tiempo, se ablanda la parte carnosa del fruto.
Ello es el resultado de la digestión enzimática de la pectina,
componente principal de la lámina media. Cuando la lámina media
se debilita, las células pueden deslizarse unas sobre otras.
También durante este período, los almidones y los ácidos orgánicos
o, como en el caso del aguacate (Persea americana), los azúcares
son metabolizados a azúcares. A consecuencia de estos cambios,
los frutos se vuelven grandes y sabrosos y, por tanto, atractivos
para los animales que los comen y que, indirectamente, diseminan
las semillas.
 |
Tabla 14.1 Cambios que
tienen lugar en el fruto durante la maduración. |
|
 |
Durante
la época de maduración de muchos frutos ─incluyendo
tomates, aguacates y peras─ hay un gran incremento en la
respiración celular, manifestado por un mayor consumo de oxígeno.
Esta fase se conoce como climaterio, y los frutos
que la desarrollan, frutos climatéricos. (Los frutos que
muestran una maduración gradual, tales como los cítricos, uvas,
y fresas, se denominan frutos no climatéricos) Ver tablas
14.2 y 14.3.
 |
Tabla 14.2 Ejemplos de
algunos frutos climatéricos y no climatéricos.
|
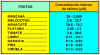 |
Tabla 14.3
Concentración interna de etileno en varios frutos climatéricos y no climatéricos.
|
 |
Cuando frutos climatéricos inmaduros se tratan con
etileno, se acelera el comienzo del climaterio. Cuando frutos no
climatéricos se tratan de la misma forma, la magnitud de la tasa
respiratorio se incrementa en función de la concentración de
etileno, pero el tratamiento no dispara la producción endógena
de etileno y por lo tanto no se acelera la maduración. |
 |
No se
conocen las relaciones entre el climaterio y los demás aspectos
de la maduración, pero cuando se reduce la intensidad de la fase
climatérica queda detenida la maduración del fruto. |
 |
Un descenso
en el oxígeno disponible suprime la respiración celular, razón
por la cual las frutas y verduras se "conservan" más
cuando son guardadas en bolsas de plástico. |
 |
El frío también la
suprime, y en algunos frutos frena de una manera permanente del
climaterio; de aquí que se aconseje a veces guardar los plátanos
en la nevera. |
 |
Los frutos pueden ser almacenados durante largos períodos
de tiempo bajo vacío. Bajo tales condiciones, la cantidad de oxígeno
disponible es mínima, lo que suprime la respiración celular, y
el etileno, que acelera el comienzo del climaterio, se mantiene en
niveles bajos. |
|
 |
Después del climaterio ya viene el envejecimiento,
y los frutos se vuelven susceptibles a las invasiones de hongos y
otros microorganismos.
|
 |
En
los primeros años de la década de 1900, muchos fruticultores hacían
un tratamiento para mejorar el color de los frutos cítricos,
consistente en "curarlos" en un recinto con una estufa
de queroseno. Durante mucho
tiempo se creyó que era el calor el causante de la maduración de
los frutos. Fruticultores ambiciosos que instalaron modernos
equipos calefactores eléctricos constataron con pesar que no era así.
Diversos experimentos han demostrado que los responsables son, en
realidad, los productos resultantes de la combustión del
queroseno. De estos gases producidos, el más activo es el
etileno. Tan sólo una parte por millón de etileno en el aire
hace adelantar el comienzo del climaterio. |
 |
En la actualidad se
ha encontrado etileno en frutos (en todos los analizados, sin
excepción), flores, hojas, tallos con hojas y raíces de muy
diversas especies, y también en ciertos tipos de hongos. El
efecto del etileno sobre la maduración de los frutos tiene
importancia agrícola.
 |
Un uso importante del etileno es el de la
maduración de tomates que son recolectados verdes y almacenados
en ausencia de etileno y tratados con éste justo antes de su
comercialización (Figura 14.21). Se emplea también en la maduración de nueces
y uvas.
 |
Figura 14.21 Efecto del etileno sobre la
maduración de los frutos. La caja de tomates de la derecha
fue mantenida durante 3 días en una habitación con una
atmósfera que contenía 100 ppm de etileno. La caja de
la izquierda fue mantenida en una atmósfera normal, sin
etileno. [Figura
tomada de Rost, T.
et al. (1998).
Plant Biology. Wadsworth Publishing Company].
|
|
|
|
 |
El
etileno y la abscisión.
 |
El etileno promueve la abscisión (caída)
de hojas, flores, y frutos en una gran variedad de especies. En
las hojas, el etileno probablemente dispara las enzimas (celulasas
y poligalacturonasas) que causan la disolución de la pared
celular asociada con la abscisión (Figura 14.22).
 |
Figura
14.22 Esquema del balance
hormonal durante la abscisión de una hoja. De acuerdo a este modelo, la
auxina favorece la persistencia de la hoja durante la fase de
mantenimiento. En la fase de inducción a la abscisión, el nivel de
auxina disminuye, mientras que el nivel de etileno aumenta. Estos
cambios en el equilibrio hormonal, incrementan la sensibilidad de las
células diana al etileno, lo cual dispara los acontecimientos que
aparecen en la fase de separación. Durante esta etapa, enzimas específicos
segregados por las células diana hidrolizan los polisacáridos de las
pared celular, lo cual conduce, finalmente, a la abscisión de la
hoja. [Figura modificada de Taiz, L. & Zeiger, E. (1991).
Plant Physiology. The Benjamin/Cummings Co., Inc.].
|
|
 |
El
etileno parece ser el primer regulador de los procesos de abscisión
en las plantas, actuando la auxina como un supresor de este
efecto.
 |
La disminución de la concentración de auxina libre en un
órgano incrementa la respuesta al etileno de células diana específicas.
Estas células diana, localizadas en las zonas de abscisión,
producen como resultado gran cantidad de enzimas hidrolíticos que
degradan los polisacáridos y las proteínas presenten en las
paredes celulares, lo que conduce a la pérdida de éstas, la
separación celular y, finalmente, a la abscisión. |
 |
El etileno es
empleado comercialmente para promover la separación de los frutos
en cerezos, zarzamoras, y uvas, haciendo por ello posible la
recolección mecánica de los mismos. |
|
|
 |
El
etileno y la epinastia.
 |
La curvatura hacia
abajo y el enrollamiento que se produce en algunas hojas cuando el
lado adaxial (haz) crece más que el lado abaxial (envés) se
denomina epinastia (Figura 14.23). El etileno y altas concentraciones de auxina
inducen epinastia.
 |
Figura 14.23 Epinastia de hojas
causada por el etileno. La planta de Coleus de la derecha fue expuesta durante 2 días a una atmósfera
de etileno; la planta de la izquierda era un control.
[Figura tomada de Moore,
R. et al.(1998), Botany. WCB McGraw-Hill. ] |
 |
El encharcamiento o las condiciones anaerobias
que pueden producirse alrededor de las raíces de algunas plantas
(tomate, por ejemplo) disparan la síntesis de etileno en el
tallo, lo que produce una respuesta epinástica. |
 |
Puesto que este
estímulo ambiental se detecta en las raíces y la respuesta al
mismo se produce en los tallos, algún tipo de "señal"
debe ser transmitidos desde las raíces a los tallos. Esta señal
es el ACC, el precursor inmediato del etileno.
 |
Se ha encontrado
que los niveles de ACC son significativamente más altos en el
xilema radical de las raíces de tomate que sufren encharcamiento
durante 1-2 días. |
 |
Debido a que el agua impide la correcta difusión
de oxígeno hasta las células de la raíz, el ACC producido no
puede convertirse en etileno en esta zona de la planta, por lo que
es transportado al tallo. |
 |
En el tallo, al entrar en contacto con
el oxígeno, rápidamente se transforma en etileno que es liberado
al aire y, como consecuencia, produce los efectos epinásticos en
las hojas. |
|
|
|
 |
El
etileno y el crecimiento de las plántulas.
 |
Ya se comentó
anteriormente la triple respuesta de las plántulas de guisante
etioladas al etileno (ver Figura 14.24). Se ha comprobado que el etileno inhibe la
elongación y promueve la expansión lateral de las células
debido a la alteración que se produce en las propiedades mecánicas
de la pared celular. Estos cambios implican una alteración en la
disposición de los microtúbulos y de las microfibrillas de
celulosa que pasan de tener una orientación transversal a una
longitudinal.
 |
Figura 14.24 Efecto
del etileno sobre el crecimiento. Un incremento en la
concentración de etileno produce sobre la plántula del
guisante (Pisum sativum) un acortamiento, un
engrosamiento, y una tendencia al crecimiento horizontal
(triple respuesta) del tallito de la misma a medida que la
concentración de la hormona aumenta. [Figura modificada de
Rost, T. et al. (1998).
Plant Biology. Wadsworth Publishing Company].
|
|
|
 |
El
etileno y la inducción de raíces.
 |
El etileno es capaz
de inducir la formación de raíces en hojas, tallos, pedúnculos
florales, y aún en otras raíces. Esta respuesta requiere la
presencia de altas concentraciones de etileno en el medio (10
μl L-1). |
|
 |
El
etileno y la inducción de feminidad en flores de plantas monoicas.
 |
El
etileno parece jugar un papel importante en la determinación del
sexo de las flores en plantas monoicas (aquéllas que tienen
flores masculinas y femeninas sobre el mismo individuo).
 |
En las
cucurbitáceas (familia Cucurbitaceae), por ejemplo, altos
niveles de giberelinas están asociados son masculinidad, y
tratamientos con etileno cambian la expresión del sexo hacia
feminidad.
 |
En estudios realizados sobre pepinos (Cucumis
sativus), se encontró que las yemas femeninas liberaban
cantidades de etileno mucho mayores que las yemas masculinas. Además,
los pepinos que crecen bajo períodos de luz de días cortos (ver
Tema siguiente), que promueve la feminidad, liberan más
etileno que aquellos que se crecen bajo condiciones de día largo.
Por todo ello, en los pepinos, el etileno participa aparentemente
en la regulación de la expresión sexual y está asociado con la
promoción de la feminidad. |
|
|
|
 |
En
la actualidad, todavía no se entiende perfectamente el mecanismo de
acción del etileno.
 |
La
maduración de los frutos es el proceso más complejo de los
regulados por el etileno. La maduración comprende una serie de
cambios metabólicos que se traducen en cambios en la textura del
fruto, el color, y el sabor, así como otros cambios que conducen
a la senescencia del fruto. El debilitamiento de las paredes
celulares asociado con la maduración se correlaciona con un
incremento en la actividad celulasa y poligalacturonasa, que
catalizan la hidrólisis de la celulosa y la pectina, los
principales componentes de la pared celular. Se ha comprobado que
durante la maduración de algunos frutos, como el tomate o el
aguacate, el etileno produce la acumulación de ARNm que llevan la
información para la síntesis de celulasa y poligalacturonasa.
Estas observaciones nos indican que el etileno regula la
transcripción de los genes que dirigen la síntesis de las
enzimas que digieren la pared celular (Figura 14.16). |
|
 |
El
etileno promueve la senescencia en flores y hojas.
 |
Senescencia:
Conjunto de procesos metabólicos que preceden a la muerte de una
célula. Es un periodo que abarca desde la madurez de una parte u
órgano de la planta hasta su muerte. |
 |
Está
caracterizado por procesos degradativos, fundamentalmente de: la
clorofila, proteínas celulares, ARN, etc. |
 |
Se
ha demostrado que la producción de etileno se incrementa durante
la senescencia de hojas y flores (ver Figura 14.25) y que
la aplicación exógena del mismo también la induce .
 |
Figura 14.25
Producción
de etileno en flores de Ipomea a lo largo del
desarrollo. [Figura modificada de ].
|
|
|
 |
El
etileno tiene importantes usos comerciales.
 |
El etileno es una de
las fitohormonas más ampliamente utilizadas en agricultura. Las
auxinas y el ACC pueden disparan la biosíntesis natural del
etileno y en algunos casos se emplean en la práctica agrícola.
Debido a su alta velocidad de difusión, el etileno es difícil de
aplicar en el campo como gas, pero esta limitación se soslaya
utilizando algún compuesto que libere etileno. |
 |
El compuesto químico
más ampliamente utilizado es el ethephon o ácido 2-cloroetilfosfónico
(nombre comercial Ethrel).
 |
El ethephon en solución acuosa es fácilmente
absorbido y transportado al interior de la planta. |
 |
Este compuesto
libera etileno lentamente lo que permite a esta fitohormona
ejerces sus efectos. De esta manera, la aplicación de ethephon
produce la maduración de manzanas y tomates, así como el cambio
de color en cítricos, y acelera la abscisión de flores y frutos. |
 |
También se emplea para promover la feminidad en cucurbitáceas,
para prevenir la auto-polinización e incrementar su producción. |
|
|
 |
El
ácido abscísico.
 |
En
algunas ocasiones la supervivencia de la planta depende de su
capacidad de restringir su crecimiento o sus actividades
reproductoras. Tras los primeros descubrimientos de hormonas
productoras del crecimiento los fisiólogos vegetales empezaron a
especular con la posibilidad de hallar hormonas controladoras del
crecimiento de acción inhibitoria.
|
 |
En 1949 se
descubrió que las yemas aletargadas del fresno y de la patata
contenían grandes cantidades de inhibidores. Estos inhibidores
bloqueaban la acción del AIA en coleoptilos de avena. Cuando
finalizaba el letargo de las yemas, descendía la proporción de
inhibidores. Estos inhibidores llegaron a ser conocidos como dorminas.
|
 |
Fue
identificado por primera vez por F. Addicott
y col., en 1963.
 |
Estudiaron
los procesos de abscisión del algodón. |
 |
Aislaron
dos compuestos: abscisina I y abscisina II. |
 |
La
abscisina II fue identificada químicamente como
ácido abscísico (ABA). |
|
 |
Ph.
Wareing estudiando la latencia en yemas de plantas leñosas
aisló la dormina. |
 |
Dormina
y abscisina resultaron ser la misma sustancia: el ABA. |
 |
Durante
la década de los años 1960, varios investigadores notificaron el
descubrimiento, en hojas y frutos, de sustancias capaces de
acelerar la abscisión. Una de ellas, que fue denominada abscisina,
fue identificada químicamente. En 1965 también fue identificada
una de las dorminas, y se vio que tanto la abscisina como la
dormina correspondían a un mismo compuesto. Este compuesto se
conoce actualmente como ácido abscísico (Figura
14.26).
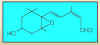 |
Figura 14.26
Estructura del ácido abscísico. |
|
 |
El
ABA es un compuesto que existe naturalmente en las plantas. Es un
sesquiterpenoide (15 carbonos) que es parcialmente producido a
partir del ácido mevalónico en cloroplastos y otros plastos.
Otros autores proponen una ruta biosintética a partir de la
degradación de los carotenoides (40 carbonos) (Figura 14.27).
El ácido abscísico (ABA) se obtiene principalmente de las bases
ováricas de los frutos. El fruto del algodón (Gossypium)
se caracteriza por proporcionarlo en gran cantidad. Las
proporciones más elevadas de ABA se dan durante la época de la
caída de los frutos.
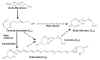 |
Figura 14.27 Rutas biosintéticas del ácido abscísico. Algunos autores
proponen una vía directa a partir del ácido mevalónico. Otros
proponen una vía indirecta a partir de la degradación de ciertos
carotenoides. La violaxantina es el carotenoide de partida. Esta es
isomerizada y escindida vía
una reacción de isomerización seguida de una de oxidación. Se
produce una molécula de xantoxina que es inestable y cambia espontáneamente
a ABA aldehido. El ABA aldehido se oxida a ABA.
|
|
|
 | Efectos
fisiológicos producidos por el ácido abscísico.
|
 |
El
ácido abscísico y la inducción de latencia en yemas y semillas.
 |
En las especies leñosas,
la latencia es una adaptación importante a los climas fríos.
Cuando llega el invierno, estos árboles protegen sus meristemos
con escamas y se paraliza temporalmente el crecimiento de estas
yemas. Esta respuesta a las temperaturas frías necesita un
mecanismo sensorial que
detecte estos cambios ambientales y un sistema de control que
traduzca esta señal y dispare el desarrollo de los procesos que
conducen a la latencia de las yemas.
 |
Inicialmente se sugirió que
era el ABA el responsable de esta inducción. Sin embargo,
posteriores análisis confirmaron que no siempre el contenido en
ABA de las yemas se correlaciona con el grado de latencia. De
todas formas, la aplicación de ABA a las yemas vegetativas las
convierten en yemas hibernantes, al transformarse los primordios
foliares en catáfilos. |
 |
Los efectos inhibidores del ABA sobre las
yemas pueden ser contrarrestados por la giberelina.
|
|
 |
El ABA parece que también actúa en la inducción de
latencia en semillas.
 |
Las semillas secas latentes contienen
usualmente grandes cantidades de ABA. |
 |
La producción de α-amilasas,
inducida por la giberelina en la semilla de cebada (Hordeum
vulgare), es inhibida por el ABA, que parece inhibir la
producción de proteínas en general. |
|
|
 |
El
ácido abscísico y la inhibición del crecimiento de los tallos.
 |
El
ABA apenas tiene efectos sobre las plantas enanas, pero reduce el
crecimiento de las plantas normales.
 |
Esta inhibición del
crecimiento puede ser contrarrestada por la giberelina. |
 |
La auxina,
por otro lado, parece actuar tanto interaccionando con la membrana
plasmática como por la aceleración de proteínas específicas.
Este crecimiento inducido por la auxina es inhibido por el ABA. |
 |
El
ABA bloquea la secreción de H+ y evita la acidificación
de la pared celular y la posterior elongación celular. |
|
|
 |
El
ácido abscísico y la inducción de la senescencia.
 |
Si se deja caer una
gota de ABA en una hoja, la zona mojada amarillea rápidamente,
aunque el resto de la hoja siga verde. Este efecto es opuesto al
producido por las citocininas. |
|
 |
El
ácido abscísico y el control de la apertura estomática.
 |
Actualmente,
no existen muchos usos prácticos para el ABA debido al escaso
conocimiento de su fisiología y bioquímica. Sin embargo, el ABA
puede tener una importancia enorme en el futuro de la agricultura,
particularmente en zonas desérticas. Hay razones para creer que
la tolerancia de algunas plantas a condiciones de estrés, tales
como la sequía, está directamente relacionada con su capacidad
para producir ABA. Además, se sabe que el ABA puede causar el
cierre de los estomas en algunas plantas, previniendo con ello la
pérdida de agua por transpiración a través de las hojas y
disminuyendo así los requerimientos hídricos de la planta.
 |
Bajo
condiciones de sequedad, las concentraciones de ABA en las hojas
pueden aumentar hasta 40 veces. |
 |
El cierre de los estomas inducido
por el ABA es una respuesta rápida y puede detectarse a los pocos
minutos. |
 |
Las células oclusivas parecen tener unos receptores
específicos para el ABA sobre la superficie exterior de su
membrana plasmática (Figura 14.28). La unión del ABA a
los mismos regula la abertura de los canales iónicos membranales
y la actividad de las bombas de protones. |
 |
El ABA parece también
modificar las propiedades de la membrana en las células radicales
lo que incrementa la entrada de agua e iones a las mismas.
 |
Figura 14.28 Modelo para
la acción de ABA en las células oclusivas de los estomas. (1) El ABA
se enlaza en un receptor, todavía sin caracterizar, situado en la
membrana plasmática. La
unión del ABA a este receptor dispara una cascada de señales. (2) El ABA produce la apertura de los canales de Ca2+, y una
despolarización temporal de la membrana. (3) Esta despolarización
temporal promueve la apertura de los canales de Cl-, que
posteriormente despolarizan la membrana. (4) El ABA incrementa los
niveles de IP3. (5) El IP3 abre los canales de
Ca2+ dependientes de IP3, produciendo una
liberación de calcio desde la vacuola. (6) El incremento del calcio
citosólico activa la apertura de los canales de Cl- (de
salida) e inhibe la de los canales de K+ (de entrada). Este
flujo neto de cargas negativas se traduce en una gran despolarización
de la membrana. (7) El ABA causa un incremento en el pH citosólico.
(8) Este incremento de pH produce la apertura de los canales de K+
y la salida de K+ al exterior. La turgencia de las células
guarda disminuye por ello, y los estomas se cierran.
|
|
|
 |
Si los genetistas vegetales son capaces de incorporar estas
características inducidas por el ABA en un rango más amplio de
plantas, podrá ser posible desarrollar nuevos cultivos que puedan
crecer en zonas desérticas. |
|
 |
Las
giberelinas.
 |
Los
agricultores japoneses fueron los primeros en observar un
fenómeno consistente en la elongación anormal del tallo en las
plántulas de arroz. Estas plantas eran
endebles y macilentas, y se quebraban con facilidad y eran
estériles. Los japoneses dieron a esta enfermedad el nombre de
"Bakanae" (enfermedad loca de las plántulas). |
 |
En
1898, Hori descubrió el agente causal de esta enfermedad
que resultó ser un patógeno fúngico del género Fusarium. |
 |
En
el mismo año (1926) en que Went realizaba sus primeros
experimentos con bloques de agar, E. Kurosawa, en el Japón,
descubrió que la causa de estos síntomas era una sustancia química
producida por Giberella fujikuroi, un hongo parásito de
las plántulas lo que produjo cierta controversia con el
descubrimiento de Hori. Esta sustancia recibió el nombre de giberelina.
|
 |
En
1931, Wollenweber aclaró la controversia al
concretar la correcta taxonomía del patógeno. Este era Fusarium
moniliforme Sheld, que es el estado asexual o imperfecto del ascomiceto
Gibberella fujikuroi
(Saw.). |
 |
En 1935, Yabuta
asiló el compuesto de Gibberella fujikuroi
y le llamó giberelina A. Este compuesto estimulaba
el crecimiento de las plántulas cuando se aplicaba a las raíces
del arroz. Debido a la II Guerra Mundial, estos trabajos pasaron
desapercibidos para Occidente hasta muchos años después. |
 |
A
principios de los 50, Stodola et al., en el "U.
S. Dept. of Agriculture" y Brian et al. de
las "Imperial Chemical Industries" en Inglaterra
descubrieron los trabajos japoneses y continuaron las
investigaciones.
 |
En
1954, Brian descubrió un nuevo compuesto a partir del hongo G. fujikuroi
y lo llamó ácido giberélico. |
 |
En
1955, los científicos norteamericanos aislaron a partir de G.
fujikuroi, además de la giberelina A, un nuevo
compuesto al que llamaron giberelina X. Los
científicos japoneses descubrieron al mismo tiempo que la
llamada giberelina A era una mezcla de tres moléculas que
ellos llamaron GA1, GA2 y GA3.
La giberelina X, la GA3 y el ácido giberélico
resultaron ser el mismo compuesto. |
|
 |
En
1956, Radley et al. por un lado y Phinney por otro
describieron compuestos similares al ácido giberélico en
plantas. |
 |
En
1957, Takahashi aisló otro compuesto a partir de G. fujikuroi al que llamó GA4. Demostró que la GA1 era
idéntica al compuesto que Stodola et al., habían llamado
giberelina A. |
 |
En 1958, MacMillan y Suter
fueron los primeros en aislar e
identificar GA1 a partir de plantas. El mismo año, West
y Murashige también detectaron GA1 en plantas
superiores. |
 |
Desde aquel entonces se han aislado giberelinas de
muchas especies de plantas superiores, y, en general, en el
momento presente se cree que se den en todas las plantas
superiores. Se presentan en cantidades variables en todos los órganos
de la planta, pero las concentraciones mayores se alcanzan en las
semillas inmaduras. |
 |
Actualmente hay más de
90 giberelinas
aisladas de tejidos vegetales, que han sido identificadas químicamente.
Varían algo en estructura (Figura 14.29), y también en
actividad. La mejor conocida del grupo es la GA3 (ácido
giberélico), producida por el hongo cuya actividad fue
descubierta por Kurosawa. |
 |
Las giberelinas
provocan efectos sorprendentes en el alargamiento de plantas
intactas. La respuesta más observada en las plantas superiores es
un incremento notable en el crecimiento del vástago; a menudo los
tallos se vuelven largos y delgados, con pocas ramas, y las hojas
empalidecen. Las giberelinas estimulan a la vez la división
celular y, afectan tanto a las hojas como a los tallos.
 |
Figura
14.29 Tres de las más de 65 giberelinas que han sido aisladas
de fuentes naturales. El ácido giberélico (GA3) es la más
abundante en hongos y la biológicamente más activa en muchos test.
Las flechas indican las diferencias estructurales menores que
distinguen los otros dos ejemplos de giberelinas, la GA7 y
la GA4. [Figura modificada de Raven,
P.H. & Eichhorn, S.E. (1992).
Biología de las
Plantas. Vol. II, Ed. Reverté,
Barcelona].
|
|
|
 | Biosíntesis
de las giberelinas.
 |
Todas
las giberelinas conocidas derivan del anillo del
gibano. Son terpenoides. |
 |
En
su biosíntesis se sigue la ruta del ácido mevalónico.
 |
En
todas las plantas esta ruta es común hasta llegar al GA12-aldehido. |
 |
A
partir de este punto, las diferentes especies siguen rutas
distintas para formar las más de 90 giberelinas conocidas hoy
día. |
 |
Una
vez fabricadas pueden darse un gran número de
interconversiones entre ellas. |
|
 |
nLas
hojas jóvenes son los principales lugares de producción
de giberelinas.
 |
Posteriormente
son translocadas vía floema al resto de la planta. |
 |
Las
raíces también las producen exportándolas al tallo vía
xilema. |
|
 |
Se
han encontrado también altos niveles de giberelinas en semillas
inmaduras. |
|
 | Efectos
fisiológicos producidos por las giberelinas.
|
 |
Las
giberelinas y los mutantes enanos.
 |
Los
resultados más manifiestos se observan cuando se aplican
giberelinas a algunas plantas con enanismo debido a un solo gen
mutante (Figura 14.30). Tratadas con giberelina, tales
plantas llegan a confundirse con las normales. Este efecto
espectacular hace pensar que el resultado de la mutación, en términos
bioquímicos, ha sido una pérdida de la capacidad de la planta
para sintetizar sus propias giberelinas.
 |
Figura
14.30 Aspecto
de plantas de judía (Phaseolus vulgaris) mutantes y normales.
(A)
Mutante ultra-enano que no produce GAs. (B) Mutante enano que sólo
produce GA20. (C) Planta normal que produce GA1. (D) Planta mutante enana a la que se añaden GAs exógenas.
[Figura modificada de
Taiz, L. and
Zieger, E., (1998), “Plant
Physiology”. 2nd ed., Sinauer Associates, Inc., Publishers].
|
 |
En maíz, por ejemplo, se han identificado cuatro tipos de
mutantes enanos, cada uno de ellos defectivo en una etapa específica
de la ruta de biosíntesis de la giberelina. |
 |
Actualmente, estudios
de la bioquímica de esta hormona en estos mutantes ha conducido a
una importante conclusión. Aunque las plantas de maíz contienen
nueve compuestos diferentes que
cumplen la definición operacional de giberelina (esto es,
la producción de una respuesta fisiológica), sólo el producto
final de la ruta causa efectos directamente. Las otras ocho
"giberelinas" necesitan ser metabolizadas posteriormente
antes de producir una respuesta fisiológica. |
|
 |
El bioensayo común
para estas hormonas consiste en probar sus efectos sobre plantas
enanas; el gran crecimiento provocado en éstas por las
giberelinas no puede ser logrado por la auxina o por cualquier
otra de las fitohormonas conocidas. |
|
 |
Las
giberelinas y la inducción de la germinación en las semillas.
 |
Las semillas de la
mayoría de las plantas precisan un período de letargo antes de
que puedan germinar. En determinadas plantas, normalmente el
letargo sólo puede ser interrumpido por la acción del frío o de
la luz. |
 |
En muchas especies, entre las que cabe incluir la lechuga,
el tabaco, y las avenas espontáneas, las giberelinas pueden
sustituir el factor que interrumpe el letargo, promoviendo así el
crecimiento del embrión y la salida de la plántula.
 |
Específicamente,
las giberelinas aumentan la elongación celular, haciendo posible
que las raíces puedan atravesar las cubiertas de las semilla. |
 |
Este efecto de las giberelinas tiene, al menos, una aplicación práctica.
El ácido giberélico acelera la germinación de las semillas y
por ello asegura uniformidad en la producción de la malta de
cebada usada en cervecería. |
|
|
 |
Las
giberelinas y la modificación de la juvenilidad.
 |
Los
estadios juveniles de algunas plantas son diferentes de sus
estadios adultos.
 |
Entre las dicotiledóneas anuales, la judía (Phaseolus),
cuyas hojas jóvenes son simples y las adultas compuestas
(trifoliadas), suministra un buen ejemplo de tal heterofilia.
|
 |
Entre las perennes, muchas especies de Eucalyptus muestran
sorprendentes diferencias entre sus hojas jóvenes y adultas (Figura
14.31).
 |
Figura 14.31 Hojas
juveniles (A) y maduras (B) de Eucalyptus
globulus, en las que se pueden apreciar las grandes
diferencias que puede haber dentro de una misma especie.
Las hojas juveniles son opuestas y más blandas que las
otras. Su única capa de parénquima en empalizada está
situada justo por debajo de la epidermis superior. Las
hojas maduras son duras, se disponen en espiral sobre el
tallo, y penden verticalmente. En las hojas maduras,
tanto el haz como el envés están expuestas a la luz, y
existe parénquima en empalizada en las 2 caras. [Figura
modificada de de Moore,
R. et al. (1998), Botany. WCB McGraw-Hill. ]
|
|
|
 |
La
hiedra (Hedera helix) es otro buen ejemplo de ello. Si se
tiene ocasión de observar una hiedra sobre una pared, compárense
las ramas superiores, adultas, con las inferiores; la forma de la
hoja es diferente. Las ramas jóvenes emiten raíces con
facilidad, las maduras no. Las ramas adultas florecen, las jóvenes
no (Figura 14.32).
 |
Si se coge una rama adulta y se la priva
del meristemo apical, las yemas axilares se desarrollarán y
formarán nuevas ramas adultas. Sin embargo, si se aplica
giberelina a una yema de este tipo, se convertirá en una rama
joven típica.
 |
Figura
14.32 Diferentes morfología foliar de la hiedra (Hedera helix).
(a) Forma juvenil. (b) Forma adulta. [Figura tomada de
Biology: Form and Function. Plant
Physiology. The Open University. Hodder
& Stoughton].
|
|
|
|
 |
Las
giberelinas y la floración de plantas de día largo.
 |
Algunas
plantas, como las coles (Brassica oleracea, var. capitata),
las zanahorias (Daucus carota), y la beleño (Hyoscyamus
niger), de régimen bienal, forman rosetas antes de florecer.
(En una roseta se desarrollan las hojas pero no los entrenudos).
En estas plantas la floración puede ser inducida por la llegada
de los días largos, por el frío (caso de las bienales), o por
ambos. Bajo el estímulo apropiado, los tallos se alargan -o
espigan- y la planta florece. |
 |
La aplicación de giberelina a
algunas de estas plantas de día largo permite que se espiguen y
florezcan sin necesidad de frío o de días largos (Figura
14.33).
 |
La elongación
producida se debe tanto al incremento en el número de divisiones
celulares en ciertas localizaciones como a la elongación de las células
resultantes de dichas divisiones. |
 |
Es por ello que las giberelinas
pueden ser utilizadas para producir semillas tempranas en flores
bienales. Tratando coles con ácido giberélico pueden obtenerse
semillas después de sólo una estación de crecimiento.
 |
Figura 14.33 (A)
Las coles, una planta de día largo,
permanece como planta en roseta durante
los días de tipo día corto y sólo espigará después
de haber pasado por una época de días de tipo día
largo. (B) Sin embargo, la aplicación exógena
de giberelinas induce el espigamiento y la floración
sin necesidad de haber sido estimulada naturalmente por
días tipo día largo. [Figura tomada de
Moore,
R. et al. (1998),
Botany. WCB McGraw-Hill. ] |
|
|
|
 |
Las
giberelinas y el desarrollo del fruto.
 |
En
cierto número de géneros de plantas, entre los que figuran los
lirios, las lobelias, las petunias, y los guisantes, se ha
demostrado que las giberelinas estimulan la germinación del polen
y el crecimiento del tubo polínico.
|
 |
Al igual que la auxina, las
giberelinas pueden ocasionar el desarrollo de frutos partenocárpicos,
como por ejemplo, manzanas, grosellas, pepinos, y berenjenas.
 |
En
algunos frutos, como la mandarina, la almendra y el melocotón,
las giberelinas favorecen la partenocarpia, mientras que la auxina
se muestra inefectiva.
|
|
 |
La principal aplicación de las giberelinas
es, sin embargo, en la producción de uvas de mesa. En algunos países,
se aplican anualmente grandes cantidades de ácido giberélico
sobre ciertas variedades de uva (Vitis vinifera). Estos
tratamientos producen racimos llenos de uvas de mayor tamaño (Figura
14.34).
 |
Figura
14.34 El
efecto del ácido giberélico sobre el crecimiento de las uvas
Thompson Seedles, un cultivar de Vitis vinifera. El racimo
de la izquierda contiene uvas no tratadas, mientras que el de la
derecha fue tratado con ácido giberélico. [Figura modificada de
Raven,
P.H. & Eichhorn, S.E. (1992).
Biología de las
Plantas. Vol. II, Ed. Reverté,
Barcelona].
|
|
|
 |
¿Cómo
actúan las giberelinas?
 |
Las
giberelinas incrementan tanto la división como la elongación
celular, debido a que tras la aplicación de giberelinas se
incrementa el número de células y la longitud de las mismas. En
el caso de las auxinas, el debilitamiento de la pared celular,
necesario para el alargamiento celular, está mediado en parte por
la acidificación de la misma. Sin embargo, éste no parece ser el
mecanismo de acción de las giberelinas. Las giberelinas pueden
inducir el crecimiento a través de una alteración de la
distribución de calcio en los tejidos. Los iones calcio inhiben
el crecimiento de los hipocótilos de lechuga, y esta inhibición
puede ser revertida por la aplicación de giberelina (GA3).
|
 |
Los estudios más
importantes sobre el mecanismo de acción de las giberelinas
─y de las fitohormonas en general─ han sido llevados a
cabo simultáneamente por investigadores de Japón, Australia y
Estados Unidos. Estos estudios, que fueron hechos sobre semillas
de cebada, señalan la secuencia de cambios que ocurren en el
embrión en vías de crecimiento y demuestran el papel principal
desempeñado por la giberelina es esta secuencia. Además,
suministran uno de los mejores ejemplos de como las hormonas
integran la bioquímica y la fisiología de los diferentes tejidos
de una planta. |
 |
En
las semillas de cebada (Hordeum vulgare) y de otras gramíneas
hay una capa de células especializadas, la capa de aleurona, que
está inmediatamente por debajo del episperma. Estas células son
ricas en proteína. Cuando las semillas empiezan a germinar
─tras la imbibición de agua─, el embrión desprende
giberelina, según han puesto de manifiesto estos estudios. Por
efecto de la giberelina, las células de aleurona producen enzimas
hidrolíticos, de las cuales la principal es la α-amilasa,
que desdobla el almidón en azúcares (Figura 14.35).
 |
Figura
14.35 La
liberación de azúcar desde el endospermo puede ser inducida por el
tratamiento con giberelinas (GA3). Estos datos muestran que
los azúcares sólo se producen cuando está presente la capa de
aleurona. Esta es, de hecho, la fuente de la enzima α-amilasa que
digiere el almidón almacenado en el endospermo. [Figura modificada de
Raven,
P.H. & Eichhorn, S.E. (1992).
Biología de las
Plantas. Vol. II, Ed. Reverté,
Barcelona].
|
 |
Las
enzimas digieren las reservas nutritivas almacenadas en el
endospermo amiláceo, que son entonces utilizables para el embrión,
en forma de azúcares y aminoácidos, que son absorbidos por el
escutelo y transportados a continuación hacia el embrión (Figura
14.25). De este modo, el embrión pide anticipadamente las
sustancias necesarias para su propio crecimiento, las cuales estarán
a su disposición en el momento que las necesite.
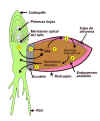 |
Figura 14.36 Acción
del ácido giberélico (GA3)
en semillas de cebada. Las giberelinas son
sintetizadas (1) por el coleoptilo y el escutelo
del embrión y liberadas en el endospermo (2);
las giberelinas difunden hacia la capa de aleurona; (3)
las células de la capa de aleurona son inducidas a
sintetizar y segregar enzimas (a-amilasas
y otras hidrolasas) en el endospermo amiláceo. (4)
el almidón y otros polímeros son degradados a pequeñas
moléculas; (5) los solutos liberados (monómeros)
son transportados hacia el embrión donde son absorbidos
y utilizados para el desarrollo del embrión.
|
|
|
 |
Los investigadores
creen que la giberelina activa ciertos genes que sintetizan moléculas
de ARNm, las cuales, a su vez, se encargan de la síntesis de las
enzimas. No ha sido demostrado que la giberelina actúe
directamente sobre el gen, aunque los investigadores han
demostrado que tanto la síntesis de RNA como la de proteínas son
necesarias para la aparición de las enzimas. Por otro lado, no se
conoce cuál pueda ser la relación entre el modo de actuación de
la giberelina en estas semillas y sus efectos en otros órganos de
la planta. |
|
 |
Aplicaciones
comerciales de las giberelinas.
 |
El
principal uso de las giberelinas es para incrementar el tamaño de
los granos de uva sin semillas. También, la utilización de una
mezcla de benciladenina (una citocinina) y GA4+7
produce la elongación del fruto en las manzanas y se utiliza para
modificar la forma de las manzanas tipo Delicius bajo determinadas
circunstancias. En los cítricos, la aplicación de giberelinas
retrasa la senescencia, por lo que los frutos pueden dejarse más
tiempo en el árbol retrasando así su comercialización. |
 |
El incremento en la
producción de enzimas hidrolíticos (α-amilasa,
fundamentalmente) se emplea comercialmente para incrementar la
producción de malta a partir de la cebada como paso previo a la
fermentación. |
 |
El
tratamiento con giberelinas puede incrementar la producción de caña
de azúcar unas 20 ton por acre y la producción de azúcar en
unas 2 ton por acre. Este incremento se debe a la elongación de
los entrenudos durante el invierno. |
|
 |
Los
efectos de las hormonas vegetales son muy
variados.
 |
Dependiendo
de la concentración en que se encuentre producen efectos
dispares, beneficiosos o perjudiciales para el interés del
agricultor. |
 |
Factores
como el elevado precio, la dificultad de aplicación, etc. limitan
mucho la utilización práctica de las hormonas vegetales. |
 |
Aplicaciones
más importantes:
 |
Retardantes
del crecimiento.
 |
Sustancias
sintéticas como el cycocel (CCC)
y el phosphon-D provocan una disminución del nivel de
giberelinas endógenas en los tejidos vegetales, y por
tanto, un crecimiento mucho más lento de los distintos órganos
vegetales. |
 |
El
CCC se usa para reducir el tamaño de la caña de los
cereales, ya que retarda la elongación de los entrenudos,
lo que previene el encamado. |
|
 |
Enraizamiento
de estaquillas.
 |
Lo
inducen sustancias como el ácido indolbutírico (IBA)
y el ácido naftalénacético (NAA). |
 |
El
etileno también lo induce. |
 |
Citocininas,
giberelinas, retardantes del crecimiento y el ácido abscísico
lo inhiben. |
|
 |
Eliminación
de la dormición de yemas y semillas.
 |
Las
giberelinas. El ácido giberélico (AG3)
se emplea en la industria cervecera para acelerar la etapa
de malteado de la cebada. |
 |
El
AG3 rompe
también la dormición de los tubérculos de patata recién
cosechados y conseguir así una brotación rápida y
uniforme. |
|
 |
Control
de la brotación de yemas.
 |
El
NAA previene la brotación de las yemas de tubérculos
de patata almacenados. |
 |
También
el MENA (éster metílico del ácido naftalenacético)
y la MH (hidrazida maleica) también inhiben la
brotación de yemas. El primero en tubérculos de patata y
el segundo en bulbos de cebolla, en zanahoria y en
remolacha. |
|
 |
Control de la floración.
 |
Aplicaciones exógenas de NAA inducen la floración
de numerosas especies frutales: floración sincronizada y fructificación uniforme. |
 |
Otras sustancias como el ethephon, CCC,
phosphon-D, inducen la floración. |
 |
Las giberelinas retrasan esta floración. |
|
 |
Desarrollo
de frutos partenocárpicos.
 |
Las
auxinas y las giberelinas inducen la partenocarpia en
frutos. |
|
 |
Aclareo
químico.
 |
El
IAA se emplea en el aclareo químico de flores y
frutos de diversas especies frutales (manzano, peral,
melocotonero,...) |
|
 |
Control
de la madurez de los frutos.
 |
El
etileno. Aplicaciones de ethephon aceleran la maduración
de algunas especies hortícolas cultivadas en invernadero
(tomate, pimiento, melón, ...) |
|
 |
Retraso
de la senescencia.
 |
La
bencilaminopurina (BAP),
el 2,4-D, el CCC, etc. retrasan la
senescencia de especies hortícolas como la coliflor, col,
lechuga, ... |
|
 |
Alteración
del tamaño, color y forma de los frutos.
 |
Las
giberelinas,
la BAP, el 2,4-D, etc. alargan los racimos
de uvas. |
|
 |
Cultivo
de tejidos.
 |
Las
auxinas y citocininas se emplean en el cultivo de tejidos
vegetales in vitro. |
|
 |
Desfoliantes y desecantes.
 |
La cianamida cálcica, el
paraquat, etc., son
sustancias que se emplean con esta
finalidad para facilitar la recolección mecanizada. |
|
 |
Herbicidas.
 |
Las auxinas sintéticas 2,4-D, 2,4,5-T, etc., se usan con esta finalidad. |
|
|
|
|

