|
|
|
 |
AVISO:
Para poder visualizar algunas imágenes se requiere el
Plugin Chemi de MDLI |
 |
Introducción
al proceso fotosintético.
 |
La vida en
la tierra depende fundamentalmente de la energía solar (Figura 11.1a), la cual es
atrapada mediante el proceso fotosintético, que es responsable de la
producción de toda la materia orgánica (Biomasa Figura 11.1b) que conocemos. La materia orgánica
comprende los alimentos que consumimos diariamente tanto nosotros como los
animales, los combustibles fósiles (petróleo, gas, gasolina, carbón); así
como la leña, madera, pulpa para papel, inclusive la materia prima para la
fabricación de fibras sintéticas, plásticos, poliéster,
etc.
|
 |
La cantidad de
carbono fijado por la fotosíntesis es espectacular, como lo demuestran las
cifras de la producción anual de materia orgánica seca, estimada en 1,55 x
1011 toneladas, con aproximadamente 60% formada en la tierra,
el resto en océanos y aguas continentales.
|
 |
Los organismos que en el curso de
la evolución aprendieron a usar la energía solar y a transformarla en
energía química son los llamados autótrofos, que están representados por
bacterias y organismos del Reino Vegetal (Figuras 11.2a y 11.2b).
|
 |
En
una planta más del 90 % de su peso seco está constituido por las
diferentes sustancias y moléculas orgánicas que forman sus
estructuras celulares o que regulan su metabolismo. Las cadenas
carbonadas iniciales que se emplean por las todas las células las
proporciona la fotosíntesis (Figura 11.3).
|

|
|
Figura 11.3
|
|
 |
La
vida en la Tierra continúa dependiendo de la fotosíntesis. Los
organismos fotosintéticos capturan la energía de la luz y, en
una serie de reacciones muy compleja, la utilizan para fabricar
los glúcidos, y liberar el oxígeno, a partir del dióxido de
carbono y del agua (Figura 11.4).
|

|
|
Figura 11.4
|
 |
Los
fotosintetizadores principales son las plantas y las algas
microscópicas marinas. Alrededor de 100,000 millones de
toneladas de carbono al año son fijadas en compuestos orgánicos
por los organismos fotosintéticos. |
 |
La
ecuación global de la fotosíntesis puede resumirse de la
siguiente manera: |
Dióxido
de carbono + Agua + Energía de la luz
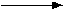 Glucosa
+ Oxígeno Glucosa
+ Oxígeno
|
 |
La
fotosíntesis es en esencia un proceso de óxido-reducción, en el
que el carbono del dióxido de carbono (CO2) se reduce
a carbono orgánico.
 |
Aunque
en algunos microorganismos fotosintéticos el proceso es algo
diferente, la fotosíntesis en las plantas consiste básicamente
en la producción de una sustancia orgánica (un glúcido
sencillo) a partir de moléculas inorgánicas (el dióxido
de carbono como sustrato a reducir, y el agua como
dador de electrones que se oxida), mediante el aprovechamiento
de la energía lumínica (que queda almacenada como
energía química dentro de la molécula sintetizada) y con
desprendimiento de oxígeno. |
 |
El
proceso global puede expresarse mediante la siguiente reacción:
6
CO2 + 6 H2O + 686 kcal/mol 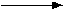 C6H12O6 + 6 O2 C6H12O6 + 6 O2
|
|
 |
El
CO2 se encuentra en la atmósfera, desde donde se
traslada por difusión (siguiendo un camino inverso al del
vapor de agua durante la transpiración), a través del
ostiolo hasta las paredes del mesófilo, y desde allí llega hasta
los cloroplastos.
 |
Este
flujo difusional es directamente proporcional a la diferencia
de concentraciones de CO2 e inversamente
proporcional a las resistencia que el camino oponga. |
 |
La
diferencia de concentraciones se establece entre la atmósfera,
cuya proporción de CO2 es de aproximadamente un
0.03 %, y el cloroplasto, donde el CO2 va siendo
transformado por fotosíntesis en otros compuestos y no llega
a acumularse en forma significativa.
 |
De
las diversas resistencias a la difusión, la más
relevante es la estomática: si los estomas se cierran
(debido a un déficit hídrico, por ejemplo) el CO2
no llegará al cloroplasto y la fotosíntesis se
interrumpirá. |
|
|
 | Para
entender cómo los organismos pueden capturar la energía solar y
almacenarla en energía química, debemos primero revisar las
características de la propia luz. |
|
 |
Desarrollo histórico.
 |
Hasta el siglo XVII siguiendo la
tradición aristotélica, se creía que las plantas absorbían del
suelo todo el alimento ya elaborado, sin ninguna participación de
la atmósfera en su nutrición. En 1648, J.B. van Helmont llevó
a cabo un experimento donde intentó demostrar que el incremento
en peso de las plantas se debía exclusivamente al agua absorbida
por las mismas (Figura 11.5). |
 |
Aparte de algunas observaciones
enunciadas anteriormente, no es hasta mediados del setecientos que
aparece un cierto interés en el mundo científico por la dinámica
vegetal, sobre todo a raíz de las investigaciones desarrolladas
tras el descubrimiento de los gases. |
 |
Charles
Bonnet, en 1749, es el
primero en interesarse por los fenómenos gaseosos relacionados
con los vegetales, llegando a algunas conclusiones erróneas al
creer que el aire que rodeaba las hojas sumergidas en agua, provenía
del exterior. |
 |
En 1772,
Joseph Priestley en sus Recherches
sur diverses especes d'air diferenció el aire de la respiración
animal de aquel emitido por los vegetales en presencia de la luz.
De este último, que denominó "aire desflogistizado",
destacó su propiedad purificadora del ambiente indicando que (ver
animaciones 11.1,
11.2
y 11.3):
 |
"las plantas lejos de
afectar el aire de la misma manera que la respiración animal,
producen los efectos contrarios, y tienden a conservar la atmósfera
dulce y salubre, cuando se vuelve perjudicial a consecuencia
de la vida y de la respiración de los animales o de su muerte
y de su putrefacción". |
 |
Igualmente detectó la emisión
de dióxido de carbono por las plantas en la oscuridad aunque
no supiera interpretar estos resultados. |
|
 |
En 1780, Jean Ingeshousz en sus Experiences
sur les vegetaux, completó y reafirmó las observaciones de
Joseph Priestley. A la vez, pudo desmentir las hipótesis de
Charles Bonnet, al demostrar que el aire expulsado de las hojas
proviene de su interior, y que el factor estimulador de la emisión
gaseosa no era el calor producido por el sol, sino la intensidad
de la luz. |
 |
Fue, finalmente,
Jean Senebier quien
entre 1782 y 1784, constató que el "aire fijo" disuelto
en el agua favorece la vegetación. A partir de estas
observaciones emitió la hipótesis de que el "aire
fijo" (dióxido de carbono) "es absorbido por las
plantas, que lo toman de la atmósfera con la humedad que ella
tiene y en la cual está mezclado". Una vez captado
este gas, tanto de la atmósfera como del suelo, es descompuesto
en presencia de la luz por las hojas, desprendiéndose el
"aire vital" (oxígeno) y quedándose el carbono en el
vegetal. |
 |
Así pues, a finales del siglo quedó
ya sentada la participación de la atmósfera en la dinámica
vegetal, aunque aún se desconocía el cómo y el porqué de esta
participación y no se había formulado ninguna teoría que
explicase el proceso nutritivo en su conjunto. |
 |
El nuevo
siglo se inicia con las
aportaciones de Theodore de Saussure. Sus teorías serán
fundamentales para esclarecer muchas de las dudas que existían
con respecto a la nutrición vegetal. Asimismo, es el primero en
detectar el fenómeno respiratorio de las plantas.
 |
En 1804, este fisiólogo, en sus Recherches
chymiques sur la vegetation trata el tema de la nutrición y
respiración vegetales en su totalidad, incorporando en sus estudios el método de análisis cuantitativo
utilizado por Lavoisier en el campo de la química. |
 |
Respecto a la nutrición carbonada,
certifica que todo el carbono asimilado procede del dióxido de
carbono absorbido. |
 |
Hasta este momento, la fotosíntesis
y la respiración vegetal son considerados como partes de un único
fenómeno. En presencia de luz, actúa la primera absorbiéndose
por las hojas el dióxido de carbono y desprendiéndose oxígeno.
En la oscuridad el proceso se invierte tomando oxígeno y
exhalando dióxido de carbono. |
|
 |
Otra contribución notable de este
período es el aislamiento e identificación de la "materia
verde" de los vegetales, que en 1818 hicieron Joseph
Pelletier y Joseph B. Caventou y que bautizan con el nombre de
"clorofila".
 |
En 1845
Robert Mayer lanza la hipótesis
sobre la transformación de la energía lumínica en energía química
mediante el concurso de la clorofila. |
|
 |
A mediados de siglo está ya
asumida la procedencia atmosférica -total o parcial- del carbono
vegetal asimilado. También esta aceptada por la comunidad científica,
la intervención de la luz y la clorofila en la nutrición de las
plantas.
 |
Jean Baptiste Boussingault demuestra en 1861 que el
volumen de dióxido de carbono absorbido es aproximadamente igual
al volumen de oxígeno desprendido. |
 |
Julius Sachs
demuestra entre 1862 y 1864 que el almidón es un producto
derivado de la función clorofílica. |
 |
M. Cloez, en 1863 determina
que la fotosíntesis solo tiene lugar en las partes de la planta
que contienen clorofila, desmintiendo así la opinión que al
respecto tenía Saussure. |
|
 |
Todas estas confirmaciones permiten
formular a Jean Baptiste Boussingault y a Julius Sachs la ecuación
clásica de la fotosíntesis:
6 CO2 + 6 H2O
+ luz
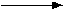 C6H12O6 + 6 O2
C6H12O6 + 6 O2
|
 |
En 1883, T.W.
Engelmann confirmó en Spirogira, el papel de la
clorofila en la fotosíntesis. |
 |
En la
década de 1920, C.B. van Niel al estudiar la fotosíntesis
en las bacterias fotosintéticas del azufre propuso que el O2 que
se liberaba en la fotosíntesis de las plantas provenía del H2O y no
del CO2. Esta hipótesis supone que el hidrógeno
utilizado para la formación de la glucosa proviene de la
descomposición del agua absorbida por la planta. El oxígeno
sobrante de la reacción es expulsado al exterior.
|
 |
En 1941, S.
Ruben y M. Kamer confirmaron a Van Niel usando un alga
verde (Chlorella) y agua radiactiva.
 | CO2
+ 2H218O + luz
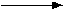 (CH2O) + H2O +
18O2
(CH2O) + H2O +
18O2 |
|
|
 | Naturaleza
de la luz.
 |
Hace
ya 300 años que el físico inglés Isaac Newton (1642-1727)
descompuso la luz visible en colores haciéndola pasar por un
prisma. Haciendo pasar la luz descompuesta por un segundo prisma,
consiguió recombinar los colores, produciendo luz blanca de
nuevo.
 |
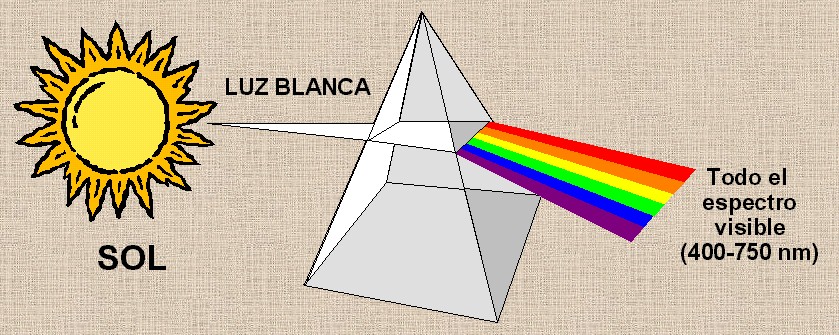
La
luz blanca se descompone en diferentes colores (color =
longitud de onda) cuando pasa por un prisma (Figura 11.6). |
|
|
|
|
Figura 11.6
Descomposición de la luz blanca en diferentes colores al
pasar por un prisma.
|
 | La luz se comporta
como una onda y como una partícula. Las propiedades de onda de la luz
incluyen la curvatura de la onda cuando pasa de un medio a otro. Las propiedades de partícula se demuestran mediante el efecto
fotoeléctrico. En el siglo
XIX, con James Clerk Maxwell (1831-1879), se
empieza a descifrar la verdadera identidad de la luz, como parte
muy pequeña de un espectro continuo de radiación, el espectro de
radiación electromagnética. Todas las radiaciones de este
espectro se comportan como ondas.
 |
La
longitud de onda, es decir, la distancia entre
la cresta de una onda y la cresta de la siguiente, va desde
décimas de nanómetro (1 nm = 10-9 m) en los
rayos gamma, hasta kilómetros (1 km = 103 m) en
las ondas de radio de baja frecuencia (Figura 11.7).
|
 |
Cada
tipo de radiación, con su longitud de onda particular, contiene una
determinada energía asociada. Cuanto más larga es la longitud de
onda, menor es la energía, y cuanto más corta es la longitud de
onda, mayor es la energía que transporta. |
|
Color |
Rango
de longitud de onda (nm) |
Longitud de
onda representativa |
Frecuencia (hertzios)
|
Energía (KJ/mol)
|
|
Ultravioleta |
<400 |
254 |
11.8 x
1014 |
471 |
|
Violeta |
400-425 |
410 |
7.31 x
1014 |
292 |
|
Azul |
425-490 |
460 |
6.52 x
1014 |
260 |
|
Verde |
490-560 |
520 |
5.77 x
1014 |
230 |
|
Amarillo |
560-585 |
570 |
5.26 x
1014 |
210 |
|
Anaranjado |
585-640 |
620 |
4.84 x
1014 |
193 |
|
Rojo |
640-740 |
680 |
4.41 x
1014 |
176 |
|
Infrarrojo |
>740 |
1400 |
2.14 x
1014 |
85 |
 |
Dentro
del espectro de luz visible, la luz violeta tiene la
longitud de onda más corta y la roja, la más larga. Los rayos
violetas más cortos contienen casi el doble de energía que los rayos
más largos de la luz roja. |
 |
Las
radiaciones con longitudes de onda menores de 400 nm (como la
luz ultravioleta) y mayores de 700 (como las infrarrojas)
pueden tener diversos efectos biológicos, pero no pueden ser
aprovechadas para la fotosíntesis (Figura 11.8).
|
 |
De
la energía que llega al cloroplasto, sólo el 40% corresponde
a la luz
visible, única radiación fotosintéticamente activa. La luz
visible es la radiación cuya longitud de onda está
comprendida entre 400 y 700 nm; es en apariencia blanca, pero
se compone, como demostró Newton, de diferentes colores, cada
uno correspondiente a un rango de ese intervalo (Figura 11.9). |
|
|
 |
Clorofila
y otros pigmentos.
 |
Para
que la energía de la luz pueda ser usada por los seres vivos,
primero ha de ser absorbida. Una sustancia que absorbe la luz se
denomina pigmento (Figura 11.10).
|
 |
Algunos
pigmentos absorben la luz en todas las longitudes de onda y por lo
tanto tienen un color negro. Otros sólo absorben ciertas
longitudes de onda y reflejan o transmiten las longitudes de onda
que no absorben. |
 |
Por
ejemplo, la clorofila, el pigmento que hace que las hojas
sean verdes, absorbe la luz en el espectro violeta y azul
y también en el rojo. Puesto que transmite y refleja la
luz verde, su aspecto es verde. |
 |
Los
diversos grupos de organismos fotosintéticos usan varios
tipos de pigmentos en la fotosíntesis (Figura 11.11). |
 |
Existen
varias clases de clorofila, que varían ligeramente en
su estructura molecular (Figura 11.12). |
 |
La
molécula de clorofila está formada por una cabeza
tetrapirrólica con un átomo de magnesio en su centro, y una
cola de fitol
(alcohol de cadena larga). |
 |
En
los eucariotas fotosintéticos (plantas y algas), la clorofila a
es el pigmento implicado directamente en la transformación de la
energía de la luz en energía química (Figura 11.13).
|
 |
La
mayor parte de las células fotosintéticas tienen también un
segundo tipo de clorofila, que en las plantas y algas verdes es la
clorofila b, y cantidades de otro grupo de pigmentos
llamados carotenoides. |
 |
Los
carotenoides (Figura 11.14), hidrocarburos polímeros del
isopreno, pueden ser de dos tipos: los carotenos
(amarillos) y las xantofilas (naranjas).
|
 |
Hay
también un tercer tipo de pigmento, las ficobilinas (Figura
11.11), de las que también hay dos tipos principales: la ficocianina
(azul) y la ficoeritrina
(roja) que se presentan también en algunos organismos
fotosintéticos.
 |
En
una hoja, estos colores quedan enmascarados por la clorofila,
más abundante. Sin embargo, en algunos tejidos, como el
tomate maduro, los colores del carotenoide pueden dominar cosa
que también pasa en otoño con las hojas de caducifolios
cuando dejan de fabricar clorofila. |
|
 |
La
clorofila b, los carotenoides y las ficobilinas son capaces
de absorber la luz a diferentes longitudes de onda de la clorofila
a. Al parecer, pueden hacer pasar la energía a la
clorofila a, con lo que se incrementa la cantidad de luz
disponible para la fotosíntesis (Figuras 11.15a y 11.15b).
|
 |
La
relación entre la fotosíntesis y la presencia de estos pigmentos
queda claramente de manifiesto cuando se compara el espectro de
acción de la fotosíntesis (eficiencia fotosintética frente
a longitud de onda) con los espectros de absorción de las
clorofilas. Tal como se observa en la Figura 11.16, ambos
espectros coinciden en lo referente a las longitudes de onda donde
la eficiencia fotosintética es más alta y donde la absorción
luminosa de los pigmentos es mayor. |
 |
Cuando
un pigmento absorbe luz, los electrones de las moléculas son
lanzados a niveles energéticos superiores (animación
11.4). En la mayoría de los
casos, los electrones vuelven a su estado inicial casi de
inmediato. La energía desprendida cuando regresan al nivel energético
puede (Figura 11.17)
 |
(1) emitirse de nuevo en una longitud de onda superior, fenómeno
que se conoce como fluorescencia (animación
11.5), |
 |
(2) disiparse en forma de
calor (conversión interna), o |
 |
(3)
ser absorbida por una molécula vecina, que lanza sus
electrones a niveles de energía superiores (transferencia
de excitón por resonancia inductiva) [animación
11.6]. |
|
 |
En
otros casos, sin embargo, la energía absorbida activa una
reacción química. La energía absorbida por el pigmento lanza un
electrón de su molécula, que entonces se oxida. Este electrón
de alta energía es captado por otra molécula, que, por lo tanto,
se reduce. Es lo que se llama fotooxidación
[animación
11.7].
La posibilidad de que la reacción química se produzca, no sólo
depende de la estructura de un determinado pigmento, sino de su
asociación con otras moléculas vecinas. La clorofila puede
convertir la energía de la luz en energía química, proceso que
se inicia con una simple oxidación-reducción, cuando se halla
asociada a determinadas proteínas y englobada en una membrana
especializada. |
 |
Cuando
una molécula de clorofila absorbe un fotón, pasa a un estado
inestable de mayor energía, denominado estado excitado, en
el que un electrón periférico se desplaza hacia una posición
más externa. Si este electrón pasa a otra molécula (fotooxidación),
la energía se habrá transmitido y la molécula de clorofila
permanecerá excitada; para volver a su estado fundamental
deberá recibir otro electrón que ocupe el hueco dejado por el
primero. Cuando coexisten numerosas moléculas de clorofila
agrupadas y ordenadas, la energía absorbida por cualquiera de
ellas puede transmitirse por resonancia (transferencia de
excitón) a todo el conjunto, sin que haya transferencia de
electrones. Ambos tipos de transferencia de energía tienen lugar
en el proceso de absorción de luz por los pigmentos fotosintéticos
[animaciones
11.8
y
11.9].
|
|
 |
Los
cloroplastos.
 |
Las
membranas especializadas, donde se encuentran embebidas la
clorofila y otros pigmentos, se llaman tilacoides.
Normalmente, presentan un aspecto de sacos o vesículas aplanadas.
En los eucariotas, los tilacoides forman parte de la estructura
interna de orgánulos especializados, los cloroplastos. El alga Chlamydomonas,
por ejemplo, contiene un cloroplasto solitario muy grande. Una
célula de hoja contiene característicamente entre 40 y 50
cloroplastos, y no es extraño encontrar unos 500.000 cloroplastos
por milímetro cuadrado de superficie foliar. |
 |
En
las plantas, los cloroplastos se encuentran presentes en todas las
células clorenquimáticas del mesófilo y de la periferia de los
tallos herbáceos (Figura 11.18a). El cloroplasto (Figuras
11.18b, 18c, 18d, y 18e) está delimitado por dos membranas
(la interna y la externa) y contiene una matriz interna o estroma.
El estroma se encuentra atravesado por todo el sistema
tilacoidal de membranas (o lamelas) que delimitan otro
compartimiento, el lumen o espacio
intratilacoidal. Los agrupamientos de tilacoides apilados
forman los grana (pilas de lamelas granales),
mientras que el resto de tilacoides forman las lamelas
estromales.
 |
Todos
los tilacoides de un cloroplasto son siempre paralelos entre
sí. Así pues, a medida que los cloroplastos se orientan
hacia la luz, los millones de moléculas de pigmento pueden
orientarse simultáneamente para optimizar la recepción, como
si fueran pequeñas antenas electromagnéticas.
|

Figura 11.18a
Micrografía óptica de una célula vegetal de Elodea
mostrando los cloroplastos (x80).
|
|
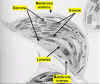
Figura 11.18b
Micrografía electrónica de un cloroplasto (x30000) |
|
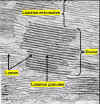
Figura 11.18d
Micrografía electrónica de una ST de un cloroplasto
de hoja de maíz (Zea mays). Detalle mostrando una
grana.
|
|
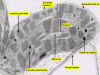
Figura 11.18c
Micrografía electrónica de una ST de un cloroplasto de
hoja de maíz (Zea mays)
|
Figura 11.18e
Esquema de un cloroplasto donde se pueden apreciar sus
componentes principales.
|
|
|
|
 |
Las
etapas de la fotosíntesis.
 |
Las
reacciones de la fotosíntesis tienen lugar en dos etapas (Figuras
11.19 y 11.20). En la primera etapa (las reacciones
dependientes de la luz) o fase
luminosa, la luz impacta en las moléculas de clorofila a
que están empaquetadas en una ordenación especial, en las
membranas tilacoidales. Los electrones de la clorofila a
son lanzados a niveles energéticos superiores, y las moléculas
de clorofila a se oxidan. En una secuencia de reacciones,
la energía que llevan estos electrones se usa para formar ATP a
partir del ADP y para reducir una molécula llamada NADP+. Las moléculas de agua se escinden en esta etapa para dar
electrones que se usan para sustituir los que se marchan de la
clorofila a. |
 |
En
la segunda etapa de la fotosíntesis (las reacciones
independientes de la luz) o fase oscura, el
ATP y el NADPH, formados durante la primera etapa, se usan para
reducir el dióxido de carbono a un glúcido sencillo. Así pues,
la energía química, temporalmente almacenada en las moléculas
de ATP y NADPH, se transfiere a moléculas diseñadas para el
transporte y el almacenaje en las células del alga o en el cuerpo
de la planta. Al nivel tiempo, se forma una cadena carbonada con
la cual pueden fabricarse otros compuestos necesarios. Esta
incorporación de dióxido de carbono en forma de materia
orgánica, se denomina fijación del carbono, y se produce
en el estroma del cloroplasto.
|
|
 |
Las
reacciones dependientes de la luz.
 |
En
el cloroplasto, los pigmentos están estrechamente asociados a
proteínas y se alojan en la bicapa lipídica de los tilacoides.
Según el modelo admitido actualmente, estos complejos
proteína-clorofila se encuentran empaquetados formando unidades
denominadas fotosistemas. Cada unidad contiene de 200 a 400
moléculas de pigmento que tienen por finalidad captar la luz como
una antena, forman el llamado complejo antena
(Figura 11.21). (ver animación
11.11b). Cuando la
energía de la luz se absorbe por uno de los pigmentos de la
antena, pasa de una molécula a otra de pigmento del fotosistema
hasta que alcanza una forma especial de clorofila a que
constituye el centro de reacción del fotosistema.
 |
Los
pigmentos antena son los encargados de absorber la energía
lumínica y transferirla por resonancia al centro de
reacción. Al recibir esta energía, la clorofila del centro
de reacción pierde un electrón, que es transferido a una
serie de transportadores de electrones. Los transportadores
actúan en cadena, captando el electrón (y por tanto
reduciéndose) y seguidamente cediéndolo (y por tanto
oxidándolo) a la siguiente molécula (ver animación
11.10).
|
 |
También
los carotenoides, que se encuentran íntimamente asociados con
las clorofilas de los complejos antena, captan energía en sus
longitudes de onda características y la transfieren a las
clorofilas (aunque con menos eficiencia); tienen además una
función protectora, ya que absorben excesos de energía que
podrían dar lugar a la formación de compuestos nocivos.
|
|
 |
Los
datos actuales indican que hay dos tipos de fotosistemas (Figura
11.22). Los dos fotosistemas se diferencian en sus
proporciones de clorofila a
y b, en las características de sus centros de reacción, y
en los transportadores de electrones que los acompañan (ver
animación
11.11).
 |
En
el fotosistema I (FS I) la molécula reactiva de
clorofila a se denomina P700, ya que
uno de los máximos, en la curva de absorción es en los 700
nm, longitud de onda ligeramente mayor que el pico normal de
la clorofila a. P700 no es una clorofila
diferente, sino que está formado por dos moléculas de
clorofila a que están unidas. Estas propiedades
diferentes se deben a la asociación con una proteína en la
membrana del tilacoide y a su posición con respecto a otras
moléculas. Este FS I se localiza, casi exclusivamente, en las
lamelas estromales y en la periferia de los grana.
|
 |
El Fotosistema
II (FS II) también contiene una molécula de
clorofila a reactiva, denominada P680,
que absorbe preferentemente a 680 nm y se localiza,
preferentemente, en las lamelas granales (grana). Es decir,
los dos tipos de fotosistemas se encuentran espacialmente
separados en las membranas tilacoidales.
|
|
 |
Durante
las reacciones de la fase lumínica los dos fotosistemas actúan
coordinadamente. Las animaciones
11.12
y
11.13 muestran el conocimiento actual de cómo funciona esta
coordinación. La energía absorbida (1 fotón) por
el FS I es transferida por el complejo antena hasta su
centro de reacción lo provoca la pérdida de un
electrón del P700, que queda entonces en un estado
inestable, con un “hueco” electrónico que será “rellenado”
por un electrón procedente del FS II. El electrón perdido
por el P700
pasa a una cadena de transportadores presente en la membrana
tilacoidal que se van reduciendo (al aceptar el electrón) y
oxidando (al transferirlo) sucesivamente, con un nivel energético
menor en cada paso. Luego de varios compuestos intermedios poco
conocidos (muchos de ellos ferrosulfoproteínas
sin grupo hemo: FX, FB, FA), el
electrón pasa a la ferredoxina, y por último a la ferredoxin
NADP+ oxidorreductasa que reduce al NADP+
(forma oxidada del NADPH), según la siguiente reacción:
NADP+
+ 2 e¯ + H+
.Ö
NADPH
 |
Como
se observa, para que se produzca esta reacción hace falta un
protón, que procede del espacio intratilacoidal, y dos
electrones, cedidos por el P700, razón por la cual
el flujo electrónico del FS I deberá tener lugar dos
veces para reducir cada molécula de NADP+,
es decir, deberán ser absorbidos 2 fotones por el FS I
para que se liberen 2 electrones.
|
 |
El
FS I funciona así como un fuerte reductor, capaz de
producir NADPH, que será utilizado en las reacciones
de la fase oscura para reducir el CO2
a carbono orgánico. |
 |
Por
otra parte, cuando la energía luminosa (un fotón)
incide sobre el fotosistema II y es transferida en último
término hasta la molécula P680
de clorofila a, de su centro de reacción, provoca que un electrón
de la molécula P680 sea impulsado a un nivel
energético superior, quedando P680 en un estado
inestable. El electrón se transfiere luego a una primera
molécula aceptora de electrones, la feofitina,
que capta electrones con un nivel electrónico superior al que
puede tener la clorofila a. A continuación (Figuras
11.23a y 11.23b), el electrón desciende por una
cadena de transporte electrónico formada por transportadores
de nivel energético sucesivamente menor: plastoquinona
(PQ), citocromo bf (cit bf), y plastocianina
(PC). De este último
compuesto, el electrón pasa a ocupar el “hueco”
electrónico del P700, que de esta manera recupera
su estado normal y queda listo para volver a absorber energía
y reiniciar el proceso. En el caso del P680, su “hueco”
electrónico será ocupado por un electrón procedente de la
oxidación del agua.
|
|
 |
El
P680 se comporta como un fuerte oxidante que,
en su estado inestable es capaz de inducir la oxidación del agua (fotólisis
del agua), en la que se desprende oxígeno (O2)
como puede verse en la siguiente reacción:
2 H2O  O2 + 4 H+ + 4 e¯ O2 + 4 H+ + 4 e¯
|
 |
A
través de ciertos transportadores poco conocidos, los electrones
liberados aquí pasan a ocupar el hueco electrónico del P680,
que queda así listo para volver a absorber energía. Los protones
que se liberan pasan a acumularse en el espacio intratilacoidal,
de donde proceden los H+ necesarios para reducir al
NADP+.
|
 |
Durante
el transporte de electrones entre el FS II y el FS I,
concretamente cuando pasan desde la PQ a los cit bf,
se libera energía que sirve para bombear protones desde el estroma
hacia el espacio intratilacoidal (lumen).
 |
Esto
hace que este espacio se vaya acidificando como consecuencia
(1) de la acumulación de los protones que pierde el agua al
oxidarse y (2) con los protones que se transfieren desde el
estroma. La concentración de protones es este compartimiento
pasa a ser mucho mayor que en el estroma, y se genera de esta
manera un potencial de membrana. Se establece, por lo tanto,
un gradiente de protones a través de la membrana tilacoidal.
|
|
 |
Los
complejos de ATP sintetasa, dispuestos en la membrana
tilacoidal (Figura 11.23b), proporcionan un canal
por el cual los protones pueden fluir a favor del gradiente, de
nuevo hacia el estroma (animación
11.14a).
Al hacerlo, la energía potencial del gradiente conduce a la
síntesis de ATP a partir del ADP y fosfato, en un proceso
quimiostático
característico de la fase luminosa denominado fotofosforilación
no cíclica. Por cada molécula de ATP formada, dos electrones deben
viajar por la cadena de transporte electrónico, desde el FS II al
FS I.
|
 |
Resumiendo,
durante la fotofosforilación no cíclica, otros
tres procesos se están produciendo simultáneamente (Figura
11.24a):
-
La
molécula de clorofila P680, habiendo perdido dos
electrones, busca ávidamente repuestos. Los encuentra en la
molécula de agua, a la cual se le arrancan los dos electrones
y luego se parte en protones y oxígeno.
-
Una
dosis adicional de energía luminosa es captada por la
molécula reactiva de clorofila (P700) del FS I. La
molécula se oxida y los electrones son lanzados a un aceptor
de electrones primario, a partir del cual descienden hacia el
NADP+. Dos electrones y un protón se combinan con
el NADP+ para formar NADPH.
-
Los
electrones separados de la molécula P700 del FS I
son sustituidos por los electrones que fueron captados por el
aceptor primario de electrones del FS II y que han descendido
por la cadena de transporte electrónico.
|
 |
Por
lo tanto, cuando hay luz, se produce un flujo continuo de
electrones:
Agua
 FS
II FS
II
 FS
I FS
I
 NADP+ NADP+
 |
Para
que dos electrones del agua sean captados por el NADP+
hacen falta 4 fotones (2 que son absorbidos por el FS
II y otros 2 que lo son por el FS I).
|
|
 |
El
recorrido de los electrones en el FS I puede seguir también un
camino cíclico (Figura 11.24b), regresando el electrón del
P700
a esta misma molécula (a través de los cit bf y la PC);
en este caso también se produce un bombeo de protones al espacio
intratilacoidal que permite la síntesis de ATP adicional
(fotofosforilación
cíclica), pero que no generará poder reductor, ya que los
electrones no llegan al NADP+, ni se liberará oxígeno,
porque no podrá haber oxidación del agua. |
|
 |
Las
reacciones independientes de la luz (la fase oscura).
 |
En
la primera fase de la fotosíntesis, la energía de la luz se
convierte en energía eléctrica -el flujo de electrones- y la
energía eléctrica se convierte en energía química que se
almacena en los enlaces del NADPH (gran poder reductor) y ATP
(alto contenido energético). En la segunda fase de la
fotosíntesis, esta energía se usa para reducir el carbono y
sintetizar glúcidos sencillos (Figura 11.25).
|
 |
Las
células fotosintéticas obtienen el carbono del CO2.
Las células de las algas obtienen el CO2 directamente
del agua que las rodea. En las plantas, en cambio, el CO2 llega
a las células a través de unos poros especializados, llamados estomas,
que se encuentran en las hojas y tallos verdes (Figura 11.26).
|
 |
Las
reacciones de la segunda fase de la fotosíntesis requieren la
presencia de las moléculas NADPH y ATP, que sólo se forman en
presencia de luz. Sin embargo, mientras haya disponibilidad de
estas moléculas, estas reacciones pueden producirse,
independientemente de si hay luz o no. Por eso se denominan
reacciones “independientes” de la luz (Figura 11.25).
|
|
 |
El
ciclo de Calvin. La ruta de las cadenas hidrocarbonadas.
 |
La
reducción del carbono tiene lugar en el estroma, en una serie
cíclica de reacciones que toma el nombre de su descubridor,
Melvin Calvin. El compuesto inicial (y final) del ciclo de Calvin
(Figura 11.27), es un glúcido de cinco carbonos (pentosa)
combinado con dos grupos fosfatos, la ribulosa difosfato (RuDP).
En este ciclo podemos distinguir tres etapas: una de fosforilación, una de
reducción y una de regeneración.
|
 |
El
ciclo comienza cuando el dióxido de carbono se une a la RuDP (Figura
11.28
y animación 11.15a),
que se escinde inmediatamente en dos moléculas de ácido
fosfoglicérico o PGAc. Esta reacción está catalizada por
una enzima específica, la RuDP carboxilasa oxigenasa
(conocida también como RuBisCO), que constituye más del
15 por ciento de la proteína del cloroplasto. De hecho, la
RuBisCO se supone que es la proteína más abundante de la Tierra.
Cada una de las moléculas de PGAc formadas en la reacción
inicial contienen tres átomos de carbono; por esto, el ciclo de
Calvin se conoce también como ruta C3.
CO2
+ RuDP  2 PGAc 2 PGAc
|
 |
El
ácido fosfoglicérico (PGAc) debe reducirse, pero para ello el
PGAc debe previamente activarse, lo que consigue
añadiendo otro grupo fosfato a su molécula mediante una fosforilación
que requiere el empleo de ATP (procedente de la fase luminosa) y
en la que se obtiene ácido difosfoglicérico (DPGAc):
2 PGAc +
2 ATP  2 DPGAC + 2
ADP
2 DPGAC + 2
ADP |
 |
Una
vez activado, el ácido está en condiciones de reducirse a
aldehído, en este caso a fosfogliceraldehido
(PGAl). En esta reducción, se consume NADPH
(procedente de la etapa luminosa), y se pierde el fosfato
adicional:
2
DPGAc + 2 NADPH  2 PGAl + 2
NADP+
+ 2 Pi
2 PGAl + 2
NADP+
+ 2 Pi
|
 |
El
PGAl es ya un glúcido sencillo, una triosa, por lo que con estas
reacciones se ha logrado la transformación del carbono
inorgánico en una molécula orgánica, y se ha cumplido lo
esencial de la fotosíntesis.
Las moléculas de PGAl así formadas pueden convertirse
fácilmente en las de su isómero, el fosfato de dihidroxiacetona
(PDHA),
y ambas pueden seguir diferentes caminos, pero buena parte del
conjunto se encaminarán a regenerar la RuDP con la que se inició
el ciclo.
 |
Esta regeneración tiene lugar a través
de complejas rutas en las que se forman azúcares-fosfato con
cadenas de 4, 5, 6 y 7 átomos de carbono, como los fosfatos de
eritrosa (4C), xilulosa (5C), fructosa (6C) y sedoheptulosa (7C),
y que llevan a la síntesis de ribulosa-fosfato, que al
fosforilarse con consumo de ATP se convierte por último en la
RuDP (Figura 11.28). |
|
 |
Las
triosas-fosfato que se forman después de la reducción y no se
emplean en la regeneración de la RuDP (PGAl y PDHA), se exportan
al citosol, mediante un transportador de la membrana
de cloroplasto (Figura 11.29) que los intercambia con Pi.
Este Pi se emplea en el cloroplasto, principalmente
para la obtención de ATP en las reacciones lumínicas de los
tilacoides.
 |
Las
triosas-fosfato en el citosol dan lugar a la síntesis de sacarosa,
a través de una serie de reacciones en las que se forman fosfatos
de fructosa y de glucosa, y UDP-glucosa; el proceso culmina al
unirse la fructosa-fosfato y la UDP-glucosa para dar
sacarosa-fosfato, cuya hidrólisis da Pi y sacarosa,
la principal forma química de transporte de azúcares en las
plantas.
|
 |
Durante
la síntesis de sacarosa se liberan grupos Pi, que al
acumularse en el citosol pueden ser intercambiados por más
triosas-fosfato del cloroplasto para continuar dicha síntesis.
Cuando el ritmo de fijación y reducción de CO2 es
mayor que el de síntesis de sacarosa, la concentración de Pi
en el citosol disminuye lo cual limita la exportación de triosas.
En estas circunstancias, los fosfatos de triosa que no se exportan
se encaminan hacia la síntesis de almidón
en los cloroplastos (Figura 11.29). Este proceso pasa por la
síntesis de fructosa-fosfato y su transformación en
glucosa-fosfato; la glucosa-fosfato a su vez reacciona con ATP
para dar ADP-glucosa, compuesto capaz de polimerizarse para dar
almidón. El almacenamiento de almidón en los cloroplastos
constituye una reserva temporal; por la noche, cuando baja la
concentración de triosas, a partir de este almidón se produce
glucosa-fosfato y, por último, fosfatos de triosa, que son
exportados al citosol para la síntesis nocturna de sacarosa.
|
|
 |
Para
establecer el balance entre los compuestos que intervienen en el
ciclo de Calvin, hasta la obtención de las triosas, conviene
analizarlo partiendo de 3 moléculas de RuDP que se carboxilan con
3 CO2
para dar 6 moléculas de PGAc; estas 6 moléculas se reducen, con
el empleo de 6 ATP y 6 NADPH (de los que se recuperan los
correspondientes ADP, Pi y NADP+); de las 6
moléculas de PGAl que se obtienen, 5 se emplean en la
regeneración que, con consumo de 3 ATP (y recuperación de 3 ADP),
produce las 3 RuDP con que se inició el ciclo de Calvin; la
molécula de triosa restante sería el producto neto de este
ciclo. Prescindiendo del ATP y el NADPH, el balance de átomos de
carbono en juego sería:
3 RuDP (15C) +
3 CO2 (3C)  1 PGAl (3C)
+ 3 RuDP (15C) 1 PGAl (3C)
+ 3 RuDP (15C)
Ver animación
11.15b
|
 |
Seis
giros del ciclo, con la introducción de seis moléculas de CO2,
son necesarios para producir el equivalente de un glúcido de seis
carbonos (Figura 11.28). La ecuación global es la
siguiente:
6 RuDP
+ 6 CO2
+ 12 NADPH
+ 12 H+ +
18 ATP
 6
RuDP + Glucosa + 12
NADP+ +
18 ADP +
18 Pi +
6 H2O 6
RuDP + Glucosa + 12
NADP+ +
18 ADP +
18 Pi +
6 H2O |
|
 |
El
problema de la fotorrespiración.
 |
En
presencia de suficiente CO2, la enzima RuDP carboxilasa
oxigenasa introduce el CO2 dentro del ciclo de Calvin
con una gran eficacia (actividad carboxilasa). Sin embargo,
cuando la concentración de CO2 en la hoja es muy
pequeña comparada con la concentración de oxígeno, la misma
enzima cataliza la reacción de la RuDP con el oxígeno (actividad oxigenasa),
en vez del CO2. Esta reacción es el primer paso de un
proceso conocido como fotorrespiración, por el cual los glúcidos
son oxidados a CO2 y agua en presencia de luz. A
diferencia de la respiración mitocondrial, la fotorrespiración
es un proceso donde la energía se pierde, y no se produce ni ATP
ni NADH. En algunas plantas, cerca del 50 % del carbono fijado en
la fotosíntesis puede ser reoxidado a CO2 durante la
fotorrespiración.
|
 |
El
proceso fotorrespiratorio se resume en la Figura 11.30 (ver
animación 11.16). La
reacción de una molécula de RuDP (5C) con O2 produce
una de PGAl (3C) y otra de ácido fosfoglicólico, que
rápidamente es hidrolizado a ácido glicólico
(2C), con pérdida de Pi.
 |
El ácido glicólico sale de
los cloroplastos y entra en los peroxisomas
(orgánulos ricos en enzimas oxidativos), donde vuelve a
reaccionar con oxígeno para dar ácido glioxílico
y peróxido de hidrógeno
(H2O2); este último compuesto es convertido
por la catalasa en agua y O2.
|
 |
El ácido glioxílico es
transformado en
glicina (2C), un aminoácido que pasa a las mitocondrias;
en estos orgánulos, dos moléculas (4C) de glicina forman una de serina
(3C), con liberación de una molécula de CO2 (1C).
|
 |
La
serina vuelve a los peroxisomas y es transformada en ácido
glicérico, que pasa a los cloroplastos y allí, por
fosforilación con empleo de ATP se convierte en PGAl. De esta
manera se recuperan para el ciclo fotosintético 3 de cada 4
átomos de carbono perdidos inicialmente como ácido
fosfoglicólico, es decir, 9 de cada 10 desviados en la
oxigenación de la RuDP. Pero como un átomo de C ya fijado (ya
que la RuDP que se oxigena procede del ciclo de Calvin) se pierde
como CO2, y sin haber producido ATP.
|
|
 |
La
luz es necesaria para que la fotorrespiración tenga lugar, ya que
su sustrato inicial es la RuDP, que se regenera en el ciclo de
Calvin con la provisión de ATP y NADPH que se producen en las
reacciones luminosas. La abundancia relativa de CO2 y
de O2 en el cloroplasto, y el resultado de la
competencia entre estos gases por la enzima RuBisCO, son los
factores determinantes de que la RuDP siga la vía fotosintética
o fotorrespiratoria.
|
 |
Las
condiciones que conducen a la fotorrespiración son bastante
comunes. El CO2 no siempre se encuentra disponible
para las células fotosintéticas de la planta. Como ya hemos
visto, entra en la hoja por los estomas, orificios especializados
que se abren y se cierran, dependiendo, entre otros factores de
la cantidad de agua. Cuando la planta está sometida a unas
condiciones calurosas y secas, debe cerrar sus estomas para evitar
la pérdida de agua. Esto provoca también una disminución del CO2
y permite que el oxígeno producido en la fotosíntesis de
acumule.
|
 |
También
sucede que cuando las plantas crecen muy juntas y el aire está
muy calmado, el intercambio de gases entre el aire que rodea la
hoja y la atmósfera global puede ser muy reducido. En estas
condiciones, el aire cercano a las hojas de la planta activa
tendrá concentraciones de CO2 demasiado pequeñas para
sus actividades fotosintéticas. Incluso si los estomas están
abiertos, el gradiente de concentración entre el exterior de la
hoja y el interior será tan poco importante, que muy poco CO2 se
podrá difundir hacia la hoja. La combinación de concentraciones
bajas de CO2
y altas concentraciones de oxígeno conduce a la fotorrespiración. |
 |
La
RuBisCO tiene una afinidad por el CO2 mucho mayor que
la que presenta por el O2, pero como la atmósfera
está mucho más concentrada en O2 (21%) que en CO2
(0.03%), esta ventaja se reduce y la relación entre
carboxilación y oxigenación es de aproximadamente 3:1. La
solubilidad de los gases disminuye cuando aumenta la temperatura,
pero este descenso es más marcado en el CO2
que en el O2, por lo que las altas temperaturas (que
además afectan al comportamiento de la enzima, aumentando su
afinidad por el O2) favorecen la oxigenación de la
RuDP y, por tanto, la vía fotorrespiratoria.
|
 |
Esta
pérdida de carbono fijado, en forma de CO2 liberado
por fotorrespiración, representa un lastre para la planta, ya que
consume materia orgánica ya formada sin producir ATP, es decir,
deshace parte de lo conseguido en la fotosíntesis.
|
 |
Es
difícil imaginar qué sentido adaptativo pueda tener este
proceso. Podría tratarse de un mecanismo que permita disipar
excesos de energía de la fase lumínica, potencialmente nocivos,
que pueden acumularse en ciertas condiciones. Es posible, por otra
parte que se trate de una vía relíctica heredada de tiempos
geológicos en los que la relación CO2/O2
de la atmósfera era mayor que la actual. En cualquier caso, el
papel de la fotorrespiración sigue sin conocerse con certeza.
|
|
 |
Una
solución: Otras vías de fijación del CO2.
 |
El
problema de la fotorrespiración queda resuelto en algunas plantas
mediante una ruta alternativa de fijación del carbono. En estos
casos, la anulación de la vía fotorrespiratoria tiene lugar
mediante un mecanismo de fijación de CO2 previo al
ciclo de Calvin que, combinado con ciertas peculiaridades
bioquímicas, anatómicas y fisiológicas de estas plantas, logra
aumentar la concentración de CO2 en las inmediaciones
de la enzima RuBisCO y así desplazar fuertemente la actividad de
esta enzima hacia la carboxilación. En estas plantas, el primer
paso de la fijación de carbono es la unión del dióxido de
carbono a una molécula llamada ácido fosfoenolpirúvico
(PEP), formando un ácido de cuatro carbonos llamado ácido oxalacético.
Hay dos grupos de plantas que utilizan esta alternativa, las plantas
C4 y las plantas
CAM. Las restantes especies, en las que el CO2
se fija para formar el compuesto de tres carbonos llamado ácido
fosfoglicérico (PGA), se conocen como plantas C3
(Figuras 11.31a y 11.31b).
|
|
 |
Las
plantas C4.
 |
Las
plantas C4 presentan una anatomía foliar peculiar,
conocida como anatomía de tipo Kranz o en corona.
En el corte transversal de estas hojas (Figuras 11.32a y 11.32b) se
observan dos tipos de células fotosintéticas: unas grandes, que
rodean a los haces conductores (a modo de “corona”) formando
una vaina, y las restantes que ocupan el mesófilo,
menores y dispuestas por lo general más o menos radialmente
alrededor de la vaina.
|
 |
En
las plantas C4 las reacciones previas al ciclo de
Calvin constituyen la llamada vía de Hatch y Slack,
que se resume en las Figura 11.33. |
 |
La
fijación del CO2
tiene lugar, en primer término de forma transitoria, en el
citosol de las células del mesófilo, donde la enzima PEP carboxilasa
lo une al ácido fosfoenolpirúvico (PEP), de tres átomos de
carbono. De esta carboxilación se obtiene, como primer producto
de fijación del CO2, un ácido dicarboxílico de
cuatro carbonos, el ácido oxalacético (Figura
11.34 y animaciones 11.17
y 11.18).
 |
Por
tanto, el CO2 que fija la enzima RuBisCO y entra al
ciclo de Calvin no procede directamente y entra al ciclo de Calvin
no procede directamente de la atmósfera, sino que ha sido fijado
transitoriamente en el mesófilo y vuelto a liberar en las
células de la vaina. Esta compartimentalización (fijación
inicial del CO2
en el mesófilo, ciclo de Calvin en la vaina) permite un mejor
aprovechamiento del CO2 ya que:
 |
La
enzima PEP carboxilasa tiene una enorme afinidad por el CO2,
y por otra parte, no tiene actividad oxigenasa, por lo que el
O2
no interfiere en la fijación.
|
 |
El
CO2 captado en el mesófilo y liberado en la vaina
resulta mucho más concentrado en ésta que en el tejido
fotosintético de las plantas C3, de manera que
compite mejor con el O2
y se favorece así la actuación como carboxilasa de la
RuBisCO. |
|
 |
El
mecanismo de bombeo de CO2 hacia la vaina tiene un
costo energético ya que por cada molécula de CO2 que
se transporta del mesófilo al ciclo de Calvin se hidrolizan 2
ATP. Las plantas C4, por tanto, emplean 5 ATP para
fijar y reducir a carbohidrato una molécula de CO2,
mientras que en las plantas C3 sólo se necesitan los
3 ATP del ciclo de Calvin. Por su mayor necesidad de energía en
forma de ATP por molécula de CO2 fijado, las plantas
C4
tendrían en principio una menor eficiencia fotosintética. Sin
embargo, debido a que el efecto de la vía de Hatch y Slack
es reducir o anular la oxigenación de la RuDP, las plantas C4
no presentan niveles detectables de fotorrespiración; las plantas
C3, en las que parte del CO2 fijado se
pierde por fotorrespiración, serían desde este punto de vista
las que tendrían una menor eficiencia fotosintética. |
 |
La
clave de esta aparente contradicción radica en las condiciones
ambientales en las que tiene lugar la fotosíntesis, especialmente
la temperatura. La ventaja de las plantas C3 (su
ahorro de ATP) se pierde en condiciones de alta temperatura, que
favorecen la oxigenación de la RuDP y por tanto las pérdidas por
fotorrespiración; con temperaturas elevadas, en general a partir
de 30ºC, la eficiencia en el uso fotosintético de la luz de las
plantas C4
es mayor que la de las C3.
|
 |
Por
otra parte, en una atmósfera de baja unidad relativa (condición
provocada o favorecida por las altas temperaturas), los estomas
tenderán a cerrase parcialmente, obstruyendo el flujo de CO2
hacia el interior de la hoja. La menor concentración interna de
CO2
favorecerá la oxigenación de la RuDP en las plantas C3,
cuya eficiencia fotosintética disminuirá. En las plantas C4,
en cambio, la fijación vía PEP carboxilasa y la
compartimentalización del proceso, favorecen una eficaz captura
del CO2 sin pérdidas por fotorrespiración, aun con
una baja concentración interna de CO2
derivada del efecto de un déficit hídrico sobre el
comportamiento estomático.
|
|
 |
En
suma, las plantas C4 se ven favorecidas en condiciones
de alta temperatura y baja humedad relativa, que son las
predominantes en los climas tropicales y subtropicales,
relativamente áridos, de las regiones de donde son originarias.
Las plantas C4
constituyen un grupo importante de especies, por lo general
adaptadas precisamente a ambientes con altas temperaturas,
iluminación intensa y escasez de agua; las especies C4
pertenecen a unas cuantas familias de Angiospermas, entre las que
destacan las Gramíneas, Amarantáceas, y Quenopodiáceas. Se
encuentran entre ellas las especies cultivadas de mayor
productividad agrícola, como el maíz (Zea mays), el sorgo
(Sorghum
bicolor) o la caña de azúcar (Saccharum officinarum), y
algunas de las malas hierbas agresivas, como Cynodon dactylon, Sorghum
halepense, Cyperus rotundus y diversas especies de Amaranthus.
 |
Las
plantas C3 se comportan más eficazmente en
condiciones de temperaturas no muy altas y alta humedad relativa.
Son C3
la mayor parte de las plantas cultivadas, como el trigo (Triticum
aestivum), el girasol (Helianthus annuus) o las coles (Brassica
oleracea).
|
|
|
 |
Las
Plantas CAM.
 |
La
sigla CAM significa, en inglés, “metabolismo ácido de las
Crasuláceas”, debido a que esta variante fotosintética se
describió inicialmente en plantas de esta familia. Actualmente se
conoce un buen número de especies CAM, pertenecientes a diversas
familias de plantas crasas o suculentas: Crassulaceae, Cactaceae,
Euphorbiaceae, Aizoaceae, etc. La piña (Ananas
comosus), perteneciente a la familia Bromeliaceae, presenta este tipo
de metabolismo.
|
 |
Se
trata en general de plantas originarias desérticas o
subdesérticas, sometidas a intensa iluminación, altas
temperaturas y pronunciados déficit hídricos, adaptadas a
condiciones de aridez bastante extremas. En estas plantas el
tejido fotosintético es homogéneo, sin vaina diferenciada, ni
tampoco clorénquima en empalizada. Pero sus estomas muestran un
peculiar comportamiento ya que, al contrario de los de las demás
plantas, se abren de noche y se cierran de día.
|
 |
El
metabolismo de las plantas CAM presenta también unas reacciones
previas al ciclo de Calvin, similares a las de las plantas C4,
y se verifica asimismo una compartimentalización, pero no
espacial (ya que el clorénquima es uniforme) sino temporal: las
reacciones del ciclo de Calvin ocurren de día, con los estomas
cerrados, mientras que las reacciones previas tienen lugar de
noche, con los estomas abiertos (Figura 11.35 y animación
11.19).
 |
Durante
la noche, los estomas abiertos permiten la fijación del CO2
atmosférico por el PEP carboxilasa en el citosol; el PEP sobre el
que actúa esta enzima procede de la degradación del almidón,
acumulado en los cloroplastos durante el día. De la
carboxilación del PEP se obtiene ácido oxalacético, que luego
es reducido a málico. El ácido málico no se transporta a otras
células sino que se acumula en la vacuola de la misma célula (Figura
11.35).
|
 |
Durante
el día, con los estomas cerrados, el málico sale de la
vacuola y se descarboxila a pirúvico; en esta reacción se libera
CO2, que entra a los cloroplastos para iniciar allí en
ciclo de Calvin. El ácido pirúvico es transformado en PEP, que
luego pasa a fosfato de triosa; las triosas en los cloroplastos
dan lugar a la síntesis y acumulación de almidón, a partir del
cual se regenerará el PEP durante la noche (Figura 11.35).
|
|
 |
Como
la incorporación del CO2 al ciclo de Calvin tiene
lugar con los estomas cerrados, su concentración dentro de la
hoja es lo suficientemente alta como para impedir que la enzima
RuBisCO actúe como oxigenasa. De esta manera se anula la
fotorrespiración en estas plantas.
|
 |
El
cierre diurno de los estomas impide las intensas pérdidas de agua
por transpiración que sufrirían estas plantas con la elevada
temperatura y bajísima humedad relativa características de las
regiones áridas y desérticas de las que son originarias. La
apertura estomática y la entrada del CO2 a la hoja,
en cambio, tienen lugar de noche, cuando la temperatura es menor,
la humedad es mayor y las pérdidas de agua por transpiración son
bajas.
|
 |
La
fijación y reducción del carbono en las plantas CAM presenta
unos requerimientos energéticos, en términos de ATP, mayores que
en las plantas C3 y C4; su rendimiento
fotosintético por unidad de tiempo es menor y su crecimiento es
más lento. Como consecuencia de la adaptación de estas plantas a
sus hábitats extremos, los mecanismos que regulan el equilibrio
entre transpiración y fotosíntesis están encaminados
fuertemente hacia la minimización de las pérdidas de agua,
asegurando así la supervivencia en el medio desértico, aunque a
costa de una menor productividad.
|
 | En
las Figuras 11.36 a 11.41 podemos ver resúmenes de
las características y propiedades de las plantas C4 y CAM
comparadas con las C3. |
|
 |
 |
 |
 |
 |
|
Figura 11.36 |
Figura 11.37 |
Figura 11.38 |
Figura 11.39 |
Figura 11.40 |
 |
|
|
|
|
|
Figura 11.41 |
|
|
|
|
 |
Factores
que afectan a la fotosíntesis.
 |
El
complejo proceso de fotosíntesis, con sus numerosos pasos que
ocurren en varias etapas y tienen lugar en distintos
compartimentos estructurales, se ve afectado por diversos
factores, tanto ambientales como endógenos o propios de la
planta.
|
 |
Entre
los factores ambientales principales se cuentan la luz,
que proporciona la energía necesaria; la concentración atmosférica
de CO2, que es la fuente de carbono; la temperatura,
debido a su influencia en todos los procesos enzimáticos y
metabólicos; también juegan un papel la disponibilidad de agua,
que puede afectar al grado de apertura estomática y por tanto a
la difusión del CO2, y la disponibilidad de nutrientes
(Figura 11.42).
|
 |
Los
factores endógenos son las características propias del vegetal
(estructurales, bioquímicas, etc.) que influyen en cualquiera de
los procesos parciales de la fotosíntesis, y resultan de la
interacción entre el genotipo y el ambiente en el que se ha
desarrollado la planta. El síndrome de caracteres anatómicos,
bioquímicos y fisiológicos que determinan que una especie sea C3,
C4, o CAM es uno de los principales factores internos
que afectan al proceso fotosintético. También influyen en la
fotosíntesis la densidad de los estomas y su sensibilidad, la
edad de la hoja y el área foliar, entre otros factores (Figura
11.43).
|
 |
Tanto
los factores internos como los ambientales interaccionan entre
sí; a modo de ejemplo, téngase en cuenta que la radiación
influye sobre la temperatura del aire, y ésta sobre su humedad
relativa y también sobre la difusión del CO2,
mientras que el ácido abscísico afecta al grado de apertura
estomática, y ciertas características epidérmicas (pelos,
ceras) influyen sobre la proporción de luz absorbida.
|
 |
Por
otra parte, la fotosíntesis está estrechamente relacionada con
los procesos metabólicos que consumen moléculas orgánicas, en
los que intervienen los gases atmosféricos. Al tiempo que la
fotosíntesis consume CO2 y libera O2, la
fotorrespiración y la respiración mitocondrial consumen O2
y liberan CO2; una elevada concentración externa de O2
favorecerá la fotorrespiración a costa de la fotosíntesis. En
consecuencia, cuando se estudia la influencia de ciertos factores
sobre la acumulación de productos de la fotosíntesis a través
de los cambios en la concentración de CO2 en la
atmósfera, en realidad se está midiendo la actividad de los tres
procesos considerados globalmente y su resultado neto.
 |
Si
se considera positiva la acumulación de sustancias orgánicas
resultantes de la fotosíntesis, llamadas genéricamente fotoasimilados,
y negativa su pérdida, puede definirse el intercambio neto de
carbono con el ambiente como:
FN = FB – (FR + RM)
donde
FB, o fotosíntesis bruta, representa la cantidad total de
fotoasimilados producida, FR representa la cantidad consumida por fotorrespiración
y RM representa las pérdidas debidas a respiración mitocondrial.
El balance puede expresarse como la cantidad de fotoasimilados
resultante de ganancias y pérdidas o fotosíntesis neta
(FN).
|
 |
La
fotosíntesis neta resulta un índice adecuado para estudiar el
efecto de algunos factores ambientales importantes sobre la
acumulación de materia orgánica de la planta, y pro tanto sobre
el aumento del peso seco, directamente relacionado con el
crecimiento.
|
|
|
 |
Iluminación
y Fotosíntesis Neta.
 |
En
la Figura 11.44 se han representado los valores de
FN que se obtienen con valores crecientes de iluminación, dejando
constantes los restantes factores.
 |
Cuando
el nivel de iluminación es muy bajo o nulo, se registran valores
de FN negativos, ya que con escasa luz la FB se interrumpirá (lo
mismo de la FR), pero la RM no se verá afectada. El valor de
iluminación señalado como I0, es el punto de compensación lumínica y
representa la cantidad de luz con la cual FN vale cero, debido a
que FB se iguala a FR + RM. Para valores de iluminación mayores
que I0, FN será siempre positiva.
 |
La
porción rectilínea en su conjunto corresponde al rango de
valores de iluminación en los que este factor se comporta como
limitante del proceso: los demás factores se encuentran en exceso
(relativo) y sólo se puede incrementar FN aumentando la
iluminación. La región curvilínea corresponde a una situación
de interacciones complejas, en las que varios factores actúan
como limitantes. En la región plana FN permanece constante y el
sistema está saturado de luz: algún otro factor que está
limitando el proceso.
|
 |
Si
se aumenta el valor de alguno de los factores que permanecían
constantes (por ejemplo, si se duplica la concentración de CO2
en el aire), se obtiene una curva similar y en parte superpuesta a
la anterior, pero de porción rectilínea más prolongada y con
una meseta más alta. Es decir, cuando otro factor es más
abundante, se prolonga el rango en el que la luz es limitante, y
se alcanzan máximos mayores (Figura 11.45).
 |
Cuando
se compara el comportamiento de una planta adaptada a una
iluminación media con el de una planta umbrófila (adaptada a
condiciones de escasa iluminación), se ve que esta última
presenta una curva similar, pero con una porción rectilínea de
mayor pendiente, con un I0
menor y con una meseta más baja. Con escasa iluminación, la
planta umbrófila será más eficiente que la heliófila, en
términos de FN, pero con luz intensa está relación se invierte.
|
 |
Las
plantas C4, que no fotorrespiran, alcanzan por lo
general valores de FN superiores a los de las plantas C3,
con regiones rectilínea y curvilínea más prolongadas, ya que
con frecuencia no llegan a saturarse con la luz natural.
|
|
|
|
|
 |
Concentraciones
de CO2 y Fotosíntesis Neta.
 |
La
relación entre la concentración de CO2 y FN es
similar a la de ésta con la luz, y se obtienen gráficos
semejantes (Figura 11.46). El rango de concentraciones de CO2
en los que éste actúa como factor limitante produce una
respuesta rectilínea, mientras que las concentraciones que
saturan el sistema, porque otro factor es limitante, tienen como
respuesta una meseta. El punto de compensación del CO2
es la concentración de este gas que corresponde a una FN igual a
cero.
|
|
|

